Ville en ionisk eller kovalent forbindelse være mere ledende i vand, når de opløste forklares?
Forklaring:
* ioniske forbindelser består af positivt ladede ioner (kationer) og negativt ladede ioner (anioner) holdt sammen af elektrostatiske kræfter. Når de opløses i vand, omgiver de polære vandmolekyler ionerne, adskiller dem og giver dem mulighed for at bevæge sig frit. Denne bevægelse af ladede partikler (ioner) skaber en elektrisk strøm, hvilket gør opløsningen ledende.
* kovalente forbindelser dannes ved deling af elektroner mellem atomer. De danner ikke ioner i opløsning, men forbliver snarere som neutrale molekyler. Da der ikke er nogen frit bevægende ladede partikler, udfører kovalente forbindelser generelt ikke elektricitet i vand.
Nøgleforskelle:
| Funktion | Ioniske forbindelser | Kovalente forbindelser |
| --- | --- | --- |
| Limning | Elektrostatiske kræfter | Elektrondeling |
| Opløste arter | Ioner | Molekyler |
| Konduktivitet | Høj | Lav |
Eksempler:
* ionisk forbindelse: Natriumchlorid (NaCl) opløses i vand til dannelse af Na+ og Cl- ioner, hvilket gør opløsningen ledende.
* kovalent forbindelse: Sukker (C12H22O11) opløses i vand, men danner ikke ioner, så opløsningen er ikke ledende.
Undtagelser:
Der er nogle undtagelser fra denne generelle regel. Nogle kovalente forbindelser, såsom saltsyre (HCI), kan ionisere i vand og blive ledende. Generelt er ioniske forbindelser imidlertid signifikant mere ledende end kovalente forbindelser i vand.
 Varme artikler
Varme artikler
-
 Ny teknik til bestemmelse af afstand i cellerIn-celleafstandsbestemmelse ved EPR afslører væsentlig strukturel information om biomakromolekyler under native betingelser. For første gang, den pulserede EPR -teknik RIDME (relaxation induced dipola
Ny teknik til bestemmelse af afstand i cellerIn-celleafstandsbestemmelse ved EPR afslører væsentlig strukturel information om biomakromolekyler under native betingelser. For første gang, den pulserede EPR -teknik RIDME (relaxation induced dipola -
 Kontrol af økologiske fødevarerKredit:American Chemical Society Økologiske fødevarer bliver stadig mere populære - og dyre. Økologisk frugt og grønt dyrkes uden syntetiske pesticider, og på grund af det, de opfattes ofte som me
Kontrol af økologiske fødevarerKredit:American Chemical Society Økologiske fødevarer bliver stadig mere populære - og dyre. Økologisk frugt og grønt dyrkes uden syntetiske pesticider, og på grund af det, de opfattes ofte som me -
 Hvordan de første biomolekyler kunne være blevet dannetKredit:Unsplash/CC0 Public Domain De kemiske forstadier til nutidens biomolekyler kunne være dannet ikke kun i dybhavet ved hydrotermiske åbninger, men også i varme damme på jordens overflade. De k
Hvordan de første biomolekyler kunne være blevet dannetKredit:Unsplash/CC0 Public Domain De kemiske forstadier til nutidens biomolekyler kunne være dannet ikke kun i dybhavet ved hydrotermiske åbninger, men også i varme damme på jordens overflade. De k -
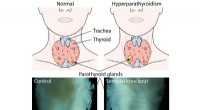 Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…Fire små biskjoldbruskkirtler placeret i nakken bag den større skjoldbruskkirtel er ansvarlige for at styre sunde blodcalciumniveauer. Primær hyperparatyreoidisme er præget af overdreven parathyreoide
Opdagelse af signalprotein kan føre til lægemiddelbaserede terapier til behandling af hyperparathy…Fire små biskjoldbruskkirtler placeret i nakken bag den større skjoldbruskkirtel er ansvarlige for at styre sunde blodcalciumniveauer. Primær hyperparatyreoidisme er præget af overdreven parathyreoide
- Europas GPS-rival Galileo lider af fejl
- Generne til glykolysenes enzymer?
- $70.000 til Zoom-undervisning? Viruskrise efterlader amerikanske studerende kede af det
- Hvad skadeligt af bakterier?
- Første forsøg med diamantamboltceller ved europæisk XFEL
- Australien markerer skrappe nye databeskyttelseslove i år


