Hvorfor udfører vandigt natriumchlorid elektricitet, men tør ikke?
vandigt natriumchlorid (saltvand)
* ioniske forbindelser: Natriumchlorid (NaCI) er en ionisk forbindelse. Dette betyder, at det findes som positivt ladede natriumioner (Na+) og negativt ladede chloridioner (Cl-) holdt sammen af elektrostatiske kræfter.
* opløsning: Når natriumchlorid opløses i vand, omgiver vandmolekylerne ionerne, bryder de ioniske bindinger og adskiller dem. Ionerne bliver frie til at bevæge sig i opløsningen.
* opladningsbærere: De frie bevægende ioner i opløsning fungerer som ladningsbærere. Når et elektrisk potentiale påføres, migrerer de positive ioner mod den negative elektrode (katode), og de negative ioner migrerer mod den positive elektrode (anode). Denne bevægelse af ladning udgør en elektrisk strøm.
tørt natriumchlorid (bordsalt)
* Krystallinsk struktur: Tørt natriumchlorid findes som et krystallinsk fast stof. I denne struktur er ionerne tæt pakket i et regelmæssigt, gentagne arrangement.
* Ingen frie ioner: Ionerne holdes stift på plads af stærke elektrostatiske kræfter. Der er ingen fri bevægelige ioner til rådighed for at bære en elektrisk strøm.
* isolator: Uden mobilafgiftsbærere udfører tørt natriumchlorid ikke elektricitet og fungerer som en isolator.
Kortfattet:
Den vigtigste forskel er tilstedeværelsen af frit bevægende ioner. Vandigt natriumchlorid har frie ioner, der kan bære en elektrisk strøm, mens tørt natriumchlorid ikke gør det.
Sidste artikelHvordan dannes fordampningssalte?
Næste artikelHvor opløselige salte udvindes fra vandet?
 Varme artikler
Varme artikler
-
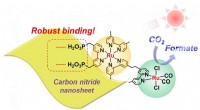 Nyt kulnitridmateriale kombineret med ruthenium forbedrer CO2-reduktionen i synligt lys i vandForskere observerede robust binding mellem rutheniummetalkomplekset og carbonnitrid nanoplader under synligt lys i vandig opløsning. Kredit: Angew. Chem. Med den igangværende udtømning af fossile
Nyt kulnitridmateriale kombineret med ruthenium forbedrer CO2-reduktionen i synligt lys i vandForskere observerede robust binding mellem rutheniummetalkomplekset og carbonnitrid nanoplader under synligt lys i vandig opløsning. Kredit: Angew. Chem. Med den igangværende udtømning af fossile -
 Forskere afslører det molekylære grundlag for synKredit:CC0 Public Domain Forskere har løst den tredimensionelle struktur af et proteinkompleks involveret i hvirveldyrs syn ved atomopløsning, et fund, der har brede implikationer for vores forstå
Forskere afslører det molekylære grundlag for synKredit:CC0 Public Domain Forskere har løst den tredimensionelle struktur af et proteinkompleks involveret i hvirveldyrs syn ved atomopløsning, et fund, der har brede implikationer for vores forstå -
 Comet inspirerer til kemi til fremstilling af åndbar ilt på MarsKonstantinos P. Giapis med sin reaktor, der omdanner kuldioxid til molekylær oxygen. Kredit:California Institute of Technology Science fiction-historier er fyldt med terraforming-skemaer og iltgen
Comet inspirerer til kemi til fremstilling af åndbar ilt på MarsKonstantinos P. Giapis med sin reaktor, der omdanner kuldioxid til molekylær oxygen. Kredit:California Institute of Technology Science fiction-historier er fyldt med terraforming-skemaer og iltgen -
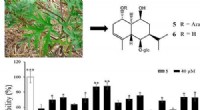 Ambrosie-forbindelser kunne beskytte nerveceller mod AlzheimersKredit:American Chemical Society Når foråret kommer på den nordlige halvkugle, mange mennesker forbander ragweed, en primær synder i sæsonbestemte allergier. Men videnskabsmænd har måske opdaget e
Ambrosie-forbindelser kunne beskytte nerveceller mod AlzheimersKredit:American Chemical Society Når foråret kommer på den nordlige halvkugle, mange mennesker forbander ragweed, en primær synder i sæsonbestemte allergier. Men videnskabsmænd har måske opdaget e
- Instrumenter til målingstemperatur
- Hvad hedder brikkerne af et delt gen i eukaryoter?
- Amazon tilbyder kasseløs teknologi til rivaliserende detailhandlere
- Hvilken enhed er passende til måling af sfæriske objekter?
- Hvad er det modsatte af Sky?
- Et rent radioaktivt stof har en halveringstid på 3 timer. Hvor lang tid ville det tage masse 12g at…


