Hvad gør 2 propanol polar?
* Tilstedeværelse af en hydroxylgruppe (OH): Hydroxylgruppen er meget polær på grund af elektronegativitetsforskellen mellem ilt og brint. Oxygen er mere elektronegativ, trækker elektrondensitet mod sig selv og skaber en delvis negativ ladning (Δ-) på ilt og en delvis positiv ladning (Δ+) på brintet.
* molekylær form: Molekylet har en bøjet form omkring iltatomet, hvilket yderligere forbedrer polariteten. Denne bøjede form forhindrer dipolmomenter i at annullere hinanden, hvilket resulterer i et netto dipolmoment.
* Hydrogenbinding: Den polære hydroxylgruppe tillader 2-propanol at danne hydrogenbindinger med andre 2-propanolmolekyler eller med andre polære molekyler, hvilket bidrager til dens overordnede polaritet.
Generelt bidrager tilstedeværelsen af den polære hydroxylgruppe, molekylets bøjede form og evnen til at danne hydrogenbindinger til den polære karakter af 2-propanol.
 Varme artikler
Varme artikler
-
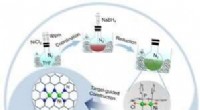 Forskere designer dinuclear-site katalysatorer og afslører den underliggende mekanismeSynteseskema. Kredit:DING Tao et al. Dinuclear-site katalysatorer (DSCer) har tiltrukket sig mere og mere opmærksomhed fra forskere på grund af deres fremragende katalytiske evne ved at inkorporer
Forskere designer dinuclear-site katalysatorer og afslører den underliggende mekanismeSynteseskema. Kredit:DING Tao et al. Dinuclear-site katalysatorer (DSCer) har tiltrukket sig mere og mere opmærksomhed fra forskere på grund af deres fremragende katalytiske evne ved at inkorporer -
 Udvidelse af omfanget af epoxidringåbningsreaktioner med zirconocenForskere demonstrerer for første gang en epoxid-ringåbningsreaktion katalyseret af zirconocen under synligt lys. Kredit:Waseda University Epoxider tilhører en klasse af organiske forbindelser kalde
Udvidelse af omfanget af epoxidringåbningsreaktioner med zirconocenForskere demonstrerer for første gang en epoxid-ringåbningsreaktion katalyseret af zirconocen under synligt lys. Kredit:Waseda University Epoxider tilhører en klasse af organiske forbindelser kalde -
 Video:Det tusind år gamle ægKredit:The American Chemical Society århundredes æg, eller pidan, er en konserveret mad fremstillet ved at gære andeæg i alkali. Den grønne og sorte farve på disse æg er ikke særlig tiltalende ved
Video:Det tusind år gamle ægKredit:The American Chemical Society århundredes æg, eller pidan, er en konserveret mad fremstillet ved at gære andeæg i alkali. Den grønne og sorte farve på disse æg er ikke særlig tiltalende ved -
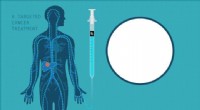 ORNL opfylder FDA's vigtigste milepæl for kræftbekæmpende Ac-225 isotopMålrettet alfaterapi kan levere stråling til specifikke celler, med minimal indvirkning på omgivelserne, sunde celler. Kredit:Michelle Lehman og Jaimee Janiga/ORNL, US Department of Energy En sjæl
ORNL opfylder FDA's vigtigste milepæl for kræftbekæmpende Ac-225 isotopMålrettet alfaterapi kan levere stråling til specifikke celler, med minimal indvirkning på omgivelserne, sunde celler. Kredit:Michelle Lehman og Jaimee Janiga/ORNL, US Department of Energy En sjæl
- Hvilken elektrisk energi omdannes til kemisk energi?
- Hvor mange celler dannes under mitose, og de er identiske?
- Singapore desinficerende robot prøvet i virusbekæmpelse
- Er Sydamerika (1) nord for ækvator (2) syd (3) både og ækvator?
- Forskere måler den elektriske ladning af nanopartikler
- Hvorfor ser alle stjerner på den nordlige halvkugle ud til at dreje sig om Polaris?


