Hvad forekommer i en reaktion, som reaktanten er fast og produktgas?
1. Kemisk transformation:
* Breaking Bonds: De kemiske bindinger inden for den faste reaktant er brudt. Dette kræver energiindgang, ofte i form af varme.
* Dannelse af nye obligationer: Atomer eller molekyler fra den faste omarrange for at danne nye bindinger, hvilket skaber det gasformige produkt. Denne proces frigiver ofte energi, undertiden i form af lys eller varme.
2. Fysiske ændringer:
* Ændring i tilstand: Den mest åbenlyse ændring er overgangen fra et fast stof til en gas, en proces kendt som sublimering (hvis det faste stof går direkte til gas) eller fordampning (hvis den faste første smelter til en væske).
* Volumenudvidelse: Gassen optager et meget større volumen end det faste stof, da gasmolekyler er meget mere spredt end i et fast stof.
* trykændringer: Volumenudvidelsen af gassen kan forårsage trykændringer i reaktionsbeholderen, især hvis reaktionen er i et lukket system.
3. Energioverførsel:
* endotermiske reaktioner: Hvis reaktionen kræver mere energi for at bryde bindingerne i det faste stof end frigivet, når man danner gassen, er reaktionen endotermisk. Det vil absorbere varme fra omgivelserne.
* eksotermiske reaktioner: Hvis der frigøres mere energi under dannelsen af gassen, end der kræves for at bryde bindingerne i det faste stof, er reaktionen eksoterm. Det frigiver varme i omgivelserne.
Eksempler:
* Tøris (fast kuldioxid) sublimering i kuldioxidgas. Dette er en endotermisk proces, da det kræver varme for at bryde bindingerne i fast co₂.
* brændende træ (cellulose) producerer kuldioxid, vanddamp og andre gasser. Dette er en eksoterm reaktion, der frigiver varme og lys.
Nøgleovervejelser:
* reaktionshastighed: Reaktionshastigheden kan påvirkes af faktorer som temperatur, tryk og overfladeareal af det faste stof. Højere temperaturer øger generelt reaktionshastigheden.
* overfladeareal: Hvis det faste stof er fint opdelt, vil det have et større overfladeareal udsat for omgivelserne, hvilket potentielt fører til en hurtigere reaktion.
* ligevægt: Hvis reaktionen er reversibel, afhænger ligevægten mellem de faste og gasfaser af faktorer som temperatur og tryk.
At forstå disse aspekter hjælper med at forudsige og kontrollere resultaterne af reaktioner, der involverer faste stoffer og gasser.
Sidste artikelHvad er fluorescerende pigmenter, og hvad er dens kemiske sammensætning?
Næste artikelHvordan renses væsker?
 Varme artikler
Varme artikler
-
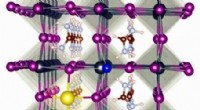 Et komplet sæt energiniveaupositioner for alle primære metalhalogenidperovskitterKredit:Eindhoven University of Technology Metalhalogenidperovskitter udgør en populær klasse af materialer med spændende optoelektroniske egenskaber. En grundlæggende forståelse af variationerne i
Et komplet sæt energiniveaupositioner for alle primære metalhalogenidperovskitterKredit:Eindhoven University of Technology Metalhalogenidperovskitter udgør en populær klasse af materialer med spændende optoelektroniske egenskaber. En grundlæggende forståelse af variationerne i -
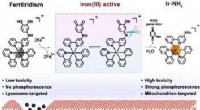 Siger mod mavekræft:Ny tilgang til selektiv kemoterapiKredit:Wiley Et nyt stof, kaldet FerriIridium, kan samtidigt hjælpe med at diagnosticere og behandle mavekræft. Den oprindeligt svagt aktive precursor (prodrug), baseret på en iridiumholdig forbi
Siger mod mavekræft:Ny tilgang til selektiv kemoterapiKredit:Wiley Et nyt stof, kaldet FerriIridium, kan samtidigt hjælpe med at diagnosticere og behandle mavekræft. Den oprindeligt svagt aktive precursor (prodrug), baseret på en iridiumholdig forbi -
 Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik
Teknik til at skabe medicin fri for bivirkningerJ. Julius Zhu sagde, at hovedideen bag forskningen var faktisk meget enkel, men det tog os mange år at få denne ting til at fungere. Kredit:Dan Addison, Universitetets kommunikation En ny teknik -
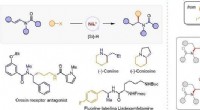 Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National
Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National
- Hvad octetreglen er tilfreds, når to atomer erhverver, hvor mange valenselektroner?
- Molekylær sværm omarrangerer overfladestrukturer atom for atom
- Hvad er risikoen forbundet med produktion af solenergi?
- Kunstig intelligens kan hjælpe dig med at beskytte dine personlige data
- Aluminium Vs. Kobberledningsevne
- Hvad er temperaturen på 8 millioner stjerne Rigel?


