Hvilke typer elektroner er ansvarlige for binding mellem atomer?
Her er hvorfor:
* valenselektroner er elektronerne i det yderste energiniveau af et atom. Disse elektroner er dem, der oplever den mindste tiltrækning til kernen og er derfor mest sandsynligt, at de interagerer med andre atomer.
* Kemisk binding opstår, når atomer deler eller overfører valenselektroner for at opnå en stabil elektronkonfiguration, typisk med en fuld ydre skal.
Der er to hovedtyper af kemiske bindinger:
* kovalente obligationer form, når atomer deler valenselektroner. Denne deling skaber en stabil elektronkonfiguration for begge involverede atomer.
* ioniske bindinger form, når et atom overfører en eller flere valenselektroner til et andet atom. Denne overførsel resulterer i dannelsen af ioner (atomer med en positiv eller negativ ladning), der tiltrækkes af hinanden.
I begge typer bindinger er det valenselektroner, der spiller den afgørende rolle i at holde atomer sammen.
Sidste artikelHvad er den naturlige form for ilt?
Næste artikelEt metal, hvis salte er opløseligt?
 Varme artikler
Varme artikler
-
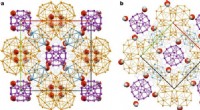 To Frank-Kasper faser i saltkrystalstrukturer observereten, Fase 1. b, Fase 2. Klynger A1, A2, B og C er farvet i lilla, orange, blå og grå, henholdsvis. I begge strukturer, lidelse er blevet fjernet for klarhedens skyld. Chlorider er blevet forbundet for
To Frank-Kasper faser i saltkrystalstrukturer observereten, Fase 1. b, Fase 2. Klynger A1, A2, B og C er farvet i lilla, orange, blå og grå, henholdsvis. I begge strukturer, lidelse er blevet fjernet for klarhedens skyld. Chlorider er blevet forbundet for -
 Ny 3-D-printet teknologi sænker omkostningerne ved almindelig medicinsk testUConn kandidatstuderende Mohamed Sharafeldin, og hans rådgiver, kemi professor James Rusling, udviklet en måde at 3D-printe en pipettespids på. Kredit:Sean Flynn/UConn Photo Et ønske om en enklere
Ny 3-D-printet teknologi sænker omkostningerne ved almindelig medicinsk testUConn kandidatstuderende Mohamed Sharafeldin, og hans rådgiver, kemi professor James Rusling, udviklet en måde at 3D-printe en pipettespids på. Kredit:Sean Flynn/UConn Photo Et ønske om en enklere -
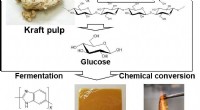 Den højeste varmebestandige plast nogensinde er udviklet af biomasseFigur 1. Udviklingsstrategi for cellulose-afledt PBI og PBI/PA film med ultrahøj termomodstand og rammehæmning. Kredit:Japan Advanced Institute of Science and Technology Brugen af biomasseafledt
Den højeste varmebestandige plast nogensinde er udviklet af biomasseFigur 1. Udviklingsstrategi for cellulose-afledt PBI og PBI/PA film med ultrahøj termomodstand og rammehæmning. Kredit:Japan Advanced Institute of Science and Technology Brugen af biomasseafledt -
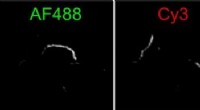 Hvordan bliver proteintangles så lange ved Alzheimers?Biofysikere har opdaget en ny mekanisme, hvormed aggregater af tauprotein, kaldet fibriller, kan vokse. To fibriller kan fastgøre ende-til-ende. Denne figur viser en fibril sammensat af mindre fibrill
Hvordan bliver proteintangles så lange ved Alzheimers?Biofysikere har opdaget en ny mekanisme, hvormed aggregater af tauprotein, kaldet fibriller, kan vokse. To fibriller kan fastgøre ende-til-ende. Denne figur viser en fibril sammensat af mindre fibrill
- Hvor mange mol atomer er der i 8 gram kulstof 13?
- Usynlige konsulenter hjælper virksomheder med at skrive bæredygtighedsrapporter. Her er hvorfor de…
- Ultrakort røntgenteknik til at undersøge forhold fundet i hjertet af planeter
- Bedre matematik summerer op til billioner i klimarelaterede besparelser:Statistikere dæmper usikker…
- Apple har idømt en bøde på millioner for australske falske iPhone-krav
- Hvad er resultatet fra en styrke, der trykker på et område?


