Hvad sker der med vandopløselighed, når kædelængden øges i carboxylsyre?
* Polaritet: Carboxylsyrer har en polær carboxylgruppe (-COOH) på grund af de elektronegative iltatomer. Denne polære gruppe kan danne hydrogenbindinger med vandmolekyler og bidrage til opløselighed.
* ikke -polær carbonhydridkæde: Efterhånden som kædelængden øges, bliver den ikke -polære carbonhydriddel af molekylet større. Denne carbonhydridkæde er hydrofob (vandafvisende) og forstyrrer den polære carboxylgruppes evne til at interagere med vandmolekyler.
* Hydrofob effekt: Den større carbonhydridkæde forstyrrer hydrogenbindingsnetværket i vand, hvilket gør det energisk ugunstigt for carboxylsyren at opløses.
Kortfattet:
* Kortkædede carboxylsyrer: Er mere opløselige i vand på grund af den dominerende virkning af den polære carboxylgruppe.
* lange kæde carboxylsyrer: Bliv mindre opløselig på grund af den stigende dominans af den ikke -polære carbonhydridkæde.
Eksempel:
* myresyre (hcooh): Meget opløselig i vand på grund af dets lille størrelse og stærke polære interaktion.
* stearinsyre (CH3 (CH2) 16COOH): Meget dårligt opløselig i vand på grund af sin lange, ikke -polære carbonhydridkæde.
 Varme artikler
Varme artikler
-
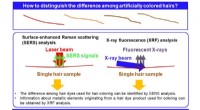 Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc
Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc -
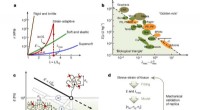 Kode til finjustering af elastomerer for at efterligne biologiske materialerProgrammering af mekanisk ydeevne. en, Den mekaniske mangfoldighed af biologiske og syntetiske materialer er illustreret ved enaksede trækspænding-deformationskurver, som afslører kombinationer af ege
Kode til finjustering af elastomerer for at efterligne biologiske materialerProgrammering af mekanisk ydeevne. en, Den mekaniske mangfoldighed af biologiske og syntetiske materialer er illustreret ved enaksede trækspænding-deformationskurver, som afslører kombinationer af ege -
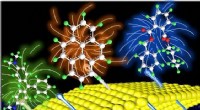 Ny Raman-metode fanger målmolekyler i små huller aktivtSkematisk diagram af princippet om den generelle overfladeforstærkede Raman-spektroskopimetode til aktivt at fange målmolekyler i små huller med opløsningsmidlet. Kredit:GE Meihong For nylig, Prof
Ny Raman-metode fanger målmolekyler i små huller aktivtSkematisk diagram af princippet om den generelle overfladeforstærkede Raman-spektroskopimetode til aktivt at fange målmolekyler i små huller med opløsningsmidlet. Kredit:GE Meihong For nylig, Prof -
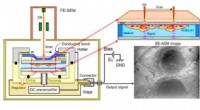 Osteoblastisk lysosom spiller en central rolle i mineraliseringScanning elektron-assisteret dielektrisk mikroskopi (SE-ADM) observation af osteoblaster. (A) Højopløsnings SE-ADM sat op til osteoblastobservation. Væskeprøveholder inklusive osteoblaster er monteret
Osteoblastisk lysosom spiller en central rolle i mineraliseringScanning elektron-assisteret dielektrisk mikroskopi (SE-ADM) observation af osteoblaster. (A) Højopløsnings SE-ADM sat op til osteoblastobservation. Væskeprøveholder inklusive osteoblaster er monteret
- Forskelle mellem middelhavsklima og fugtig subtropisk klima
- Facebook skærer ad-target muligheder for at modarbejde diskrimination
- Hvordan ved vi, at kontinenterne er flyttet?
- Hvilken struktur skal enzymer bryde?
- NASA undersøger dødbringende forårslignende vejr med GPM-satellit
- Ser på molekyler fra to sider med femtosekund bløde røntgenstråler på bordpladen


