På hvilket element baserede Bohr sin atommodel af atomer?
Her er hvorfor:
* enkelhed: Hydrogen er det enkleste atom med kun en proton og en elektron. Dette gjorde det muligt for Bohr at forenkle antagelser og fokusere på de grundlæggende interaktioner mellem kernen og elektronet.
* spektrale linjer: Bohrs model forklarede med succes de observerede spektrale linjer med brint, som var et stort puslespil på det tidspunkt. Hans model forudsagde, at elektroner kun kunne optage specifikke energiniveauer, og overgange mellem disse niveauer ville producere de observerede spektrale linjer.
* Matematisk ramme: Bohrs model brugte klassisk fysik og kvanteteorien om Planck til at udvikle en matematisk ramme, der nøjagtigt kunne forudsige energiniveauet for hydrogenatomet.
Mens Bohrs model var en banebrydende succes for brint, havde den begrænsninger, når de blev anvendt til mere komplekse atomer. Senere udvikling i kvantemekanik førte til mere nøjagtige og omfattende modeller af atomstruktur.
Sidste artikelHvor mange mol CO² produceret af Reaktionen 2.0 CH⁴ med overskydende O²?
Næste artikelHvad er en sand pH?
 Varme artikler
Varme artikler
-
 Forskning bryder ny vej i forståelsen af, hvordan en molekylær motor genererer kraftKredit:CC0 Public Domain Et team af biofysikere fra University of Massachusetts Amherst og Penn State College of Medicine satte sig for at tackle det langvarige spørgsmål om naturen af kraftgene
Forskning bryder ny vej i forståelsen af, hvordan en molekylær motor genererer kraftKredit:CC0 Public Domain Et team af biofysikere fra University of Massachusetts Amherst og Penn State College of Medicine satte sig for at tackle det langvarige spørgsmål om naturen af kraftgene -
 Upcycling af plastikposer til batterideleKredit:American Chemical Society Plastposeforurening er blevet et stort miljøproblem, får nogle byer og lande til at beskatte eller forbyde sækkene kraftigt. Men hvad nu hvis brugte plastikposer k
Upcycling af plastikposer til batterideleKredit:American Chemical Society Plastposeforurening er blevet et stort miljøproblem, får nogle byer og lande til at beskatte eller forbyde sækkene kraftigt. Men hvad nu hvis brugte plastikposer k -
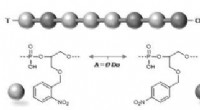 Hemmelige beskeder gemt i lysfølsomme polymererSkematisk fremstilling af et hemmeligt molekylært budskab afsløret af lys. Kredit:© Jean-François Lutz Forskere fra CNRS og Aix-Marseille Université har for nylig vist, hvor værdifulde lysfølsomme
Hemmelige beskeder gemt i lysfølsomme polymererSkematisk fremstilling af et hemmeligt molekylært budskab afsløret af lys. Kredit:© Jean-François Lutz Forskere fra CNRS og Aix-Marseille Université har for nylig vist, hvor værdifulde lysfølsomme -
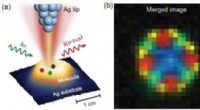 Scanning Raman picoscopy:En ny metode til bestemmelse af molekylær kemisk struktur(a) Skematisk scanning af Raman pikoskopi (SRP). Når en laserstråle fokuseres ind i nanorummet mellem den atomistisk skarpe spids og substratet, et meget stærkt og meget lokaliseret plasmonisk felt vi
Scanning Raman picoscopy:En ny metode til bestemmelse af molekylær kemisk struktur(a) Skematisk scanning af Raman pikoskopi (SRP). Når en laserstråle fokuseres ind i nanorummet mellem den atomistisk skarpe spids og substratet, et meget stærkt og meget lokaliseret plasmonisk felt vi
- Ved hjælp af vaklende stjernemateriale måler astronomer spindet af et supermassivt sort hul for fø…
- Nye detaljer om uraniumkemi viser, hvordan det binder sig til organisk stof
- Boeing foretager 96 flyafgange for at teste software på problemfyldte Max -jetfly
- Sådan konverteres trefaset strøm til forstærkere
- Galaxy Fold anmeldelse:Skal du betale $2, 000 for Samsungs forsinkede foldbare telefontablet?
- Skal en afbalanceret ligning have de samme forbindelser på hver side af ligningen?


