Hvad det er den kemiske sammensætning af sæbe?
1. Fedtsyrer:
* Dette er lange kæder af kulbrinter med en carboxylgruppe (-COOH) i den ene ende.
* De mest almindelige fedtsyrer, der findes i sæbe, er:
* mættet: Palmitinsyre (C16H32O2), stearinsyre (C18H36O2)
* umættet: Oleinsyre (C18H34O2), linolsyre (C18H32O2)
2. Alkali Metal:
* Dette er en positivt ladet ion, der binder til carboxylgruppen af fedtsyren.
* De mest almindelige alkalimetaller, der bruges til soapmaking, er:
* natrium (Na+): Producerer hård sæbe, som er fast ved stuetemperatur
* kalium (K+): Producerer blød sæbe, som er flydende eller gellignende ved stuetemperatur
Kemisk reaktion:
Reaktionen mellem en fedtsyre og et alkalimetalhydroxid (f.eks. Natriumhydroxid, NaOH) producerer sæbe og vand:
fedtsyre + alkali metal hydroxid → sæbe + vand
Eksempel:
* Stearinsyre (C18H36O2) + natriumhydroxid (NaOH) → natriumstearat (C18H35O2NA) + vand (H2O)
mekanisme til sæbehandling:
Den lange carbonhydridkæde af sæbe-molekylet er hydrofob (vandafvisende), mens carboxylgruppen er hydrofil (vand-attraherende). Denne dobbelte karakter giver sæbe mulighed for at fungere som et overfladeaktivt middel, hvilket reducerer overfladespændingen i vandet og gør det muligt for det at emulere fedt og snavs.
Kortfattet: SOAP er kemisk et salt af en fedtsyre, typisk sammensat af en lang carbonhydridkæde fastgjort til en carboxylgruppe, der er bundet til en alkali metalion. Denne unikke struktur giver sæbe sine rensningsegenskaber.
Sidste artikelHar æg en kemisk reaktion?
Næste artikelHvad hedder Compound BII3?
 Varme artikler
Varme artikler
-
 Skiller sig ud:Usædvanlig magnetisk overgang i perovskitoxid kan hjælpe med at øge spintronicsForskere fandt ud af, at PbFeO3 krystalliserede til en enestående tilstand, hvor et lag bestående af Pb2+ -ioner blev sammenflettet af to lag omfattende en blanding af Pb2+ og Pb -ioner i et 3:1 -forh
Skiller sig ud:Usædvanlig magnetisk overgang i perovskitoxid kan hjælpe med at øge spintronicsForskere fandt ud af, at PbFeO3 krystalliserede til en enestående tilstand, hvor et lag bestående af Pb2+ -ioner blev sammenflettet af to lag omfattende en blanding af Pb2+ og Pb -ioner i et 3:1 -forh -
 Teknologisk stråle af håb for snowboardscenenJakob Schmidt og Marc Fleischmann, forskningsassistenter ved Institut for Tekstilteknologier ved Chemnitz University of Technology, kontrollere kvaliteten af et splitboards præform på pladespilleren
Teknologisk stråle af håb for snowboardscenenJakob Schmidt og Marc Fleischmann, forskningsassistenter ved Institut for Tekstilteknologier ved Chemnitz University of Technology, kontrollere kvaliteten af et splitboards præform på pladespilleren -
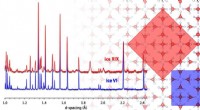 Ny krystallinsk isform:Forskere belyser krystalstruktur for eksotisk is XIXIllustration, der viser forholdet mellem is VI og XIX enhedscellerne set ned ad deres c-akser, og forskellene i deres diffraktionsmønstre, med farvekodning rød for is XIX og blå for is VI. Kredit:Uni
Ny krystallinsk isform:Forskere belyser krystalstruktur for eksotisk is XIXIllustration, der viser forholdet mellem is VI og XIX enhedscellerne set ned ad deres c-akser, og forskellene i deres diffraktionsmønstre, med farvekodning rød for is XIX og blå for is VI. Kredit:Uni -
 Konstruerede defekter i krystallinsk materiale øger den elektriske ydeevneXiaoli Tan og et team af campus-samarbejdspartnere brugte dette transmissionselektronmikroskop på Ames Laboratorys Sensitive Instrument Facility til at studere virkningerne af tekniske defekter i viss
Konstruerede defekter i krystallinsk materiale øger den elektriske ydeevneXiaoli Tan og et team af campus-samarbejdspartnere brugte dette transmissionselektronmikroskop på Ames Laboratorys Sensitive Instrument Facility til at studere virkningerne af tekniske defekter i viss
- Krig erklæret mod verdener, der vokser e-affaldskrise
- Hydrogen-elektrisk elektrisk flyvende køretøj:Lang vej til liftoff
- Reaktion af n glucosamin med mælkesyre?
- Verdens daglige temperaturrekorder er smadret – her er hvordan vi ved det
- Ny proces opdaget til fuldstændig at nedbryde flammehæmmere i miljøet
- Hvem var den første person, der kortlagde Texas -kystlinjen?


