Hvordan påvirker katalysatorer energien fra en reaktion?
1. Sænkning af aktiveringsenergi:
* aktiveringsenergi (EA) Er den minimale energi krævet for at reaktanter skal overvinde energibarrieren og danne produkter.
* Katalysatorer giver en alternativ reaktionsvej med en lavere aktiveringsenergi. Dette betyder, at reaktanter har brug for mindre energi for at starte reaktionen, hvilket fører til en hurtigere reaktionshastighed .
2. Ingen ændring i entalpi:
* entalpi (ΔH) Repræsenterer forskellen i energi mellem reaktanter og produkter.
* Katalysatorer påvirker ikke energiniveauet for reaktanter eller produkter. Derfor forbliver ΔH den samme om en katalysator er til stede eller ej.
Visualisering af effekten:
Forestil dig en bakke, der repræsenterer energibarrieren for en reaktion. Reaktanterne er i bunden af bakken, og produkterne er på et lavere punkt på den anden side.
* uden en katalysator: Reaktanterne er nødt til at klatre op på en høj bakke for at nå produkterne.
* med en katalysator: Katalysatoren skaber en tunnel gennem bakken, hvilket giver en lettere sti for reaktanterne til at nå produkterne, hvilket kræver mindre energi.
Sammendrag:
* Katalysatorer Sænk aktiveringsenergien , der fremskynder reaktionen.
* Katalysatorer Skift ikke entalpiændringen , hvilket betyder, at den samlede energiforskel mellem reaktanter og produkter forbliver den samme.
Bemærk:
Katalysatorer kan deltage i reaktionen, men de regenereres i slutningen, så deres samlede koncentration forbliver uændret. Dette giver dem mulighed for at fremskynde reaktionen uden at blive fortæret selv.
 Varme artikler
Varme artikler
-
 Ny højhastighedstest viser, hvordan antibiotika kombineres for at dræbe bakterierMed den modificerede agarplade CombiANT er det muligt at lave højhastighedstests for at se, hvordan bakterier reagerer på forskellige kombinationer af antibiotika. Kredit:Nikos Fatsis-Kavalopoulos
Ny højhastighedstest viser, hvordan antibiotika kombineres for at dræbe bakterierMed den modificerede agarplade CombiANT er det muligt at lave højhastighedstests for at se, hvordan bakterier reagerer på forskellige kombinationer af antibiotika. Kredit:Nikos Fatsis-Kavalopoulos -
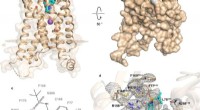 Undersøgelse afslører strukturen af receptor impliceret i type 2 -diabetes og mereFig. 1:Struktur og bindingssted for hBLT1. Kredit:Michaelian, N., et al. Naturkommunikation , https://doi.org/10.1038/s41467-021-23149-1 Forskere fra University of Southern California, Merck &Co
Undersøgelse afslører strukturen af receptor impliceret i type 2 -diabetes og mereFig. 1:Struktur og bindingssted for hBLT1. Kredit:Michaelian, N., et al. Naturkommunikation , https://doi.org/10.1038/s41467-021-23149-1 Forskere fra University of Southern California, Merck &Co -
 Hygroskopiske polymergeler:Opsamling af ferskvand og energi fra atmosfærisk fugtSyntesestrategier og AME-anvendelser af HPGer. Kredit:NIMTE Den globale befolkningseksplosion har udløst en enorm efterspørgsel efter ferskvand og energi. På trods af de store fremskridt inden for
Hygroskopiske polymergeler:Opsamling af ferskvand og energi fra atmosfærisk fugtSyntesestrategier og AME-anvendelser af HPGer. Kredit:NIMTE Den globale befolkningseksplosion har udløst en enorm efterspørgsel efter ferskvand og energi. På trods af de store fremskridt inden for -
 Kemikere finder nye måder at nedbryde gamle dæk til materiale til nyeKandidatstuderende Sijia Zheng afbilledet med Michael Brook fra McMaster University Kredit:Georgia Kirkos, McMaster University Et team af kemikere ved McMaster University har opdaget en innovativ
Kemikere finder nye måder at nedbryde gamle dæk til materiale til nyeKandidatstuderende Sijia Zheng afbilledet med Michael Brook fra McMaster University Kredit:Georgia Kirkos, McMaster University Et team af kemikere ved McMaster University har opdaget en innovativ
- NASA udvælger økonomiske forskningsundersøgelser til at undersøge investeringer i rummet
- Hvad er fuction af roterende næsestykke eller tårn?
- Sådan handler du en lavteknologisk bil
- Hvilken del af England gennemgår den primære Meridian?
- For 6.000 år siden var Sahara-ørkenen tropisk – hvad skete der?
- NASA ser tyfonen Noru på vej mod vest i det nordvestlige Stillehav


