Hvad forklarer observationen af, at elementer i samme kemiske gruppe har egenskaber?
Her er en sammenbrud:
* Elektronkonfiguration: Elementer i den samme gruppe har det samme antal valenselektroner. Valenselektroner er elektronerne i det yderste energiniveau af et atom. Disse elektroner er dem, der er involveret i kemisk binding, som direkte påvirker elementets kemiske opførsel.
* Lignende reaktivitet: Fordi de har det samme antal valenselektroner, har elementer i en gruppe en tendens til at danne lignende kemiske bindinger og reagere på lignende måder. For eksempel har alle alkalimetaller (gruppe 1) en valenselektron, hvilket gør dem meget reaktive og tilbøjelige til at miste dette elektron til dannelse af positive ioner.
* Periodiske tendenser: Den periodiske tabel er organiseret baseret på tilbagevendende mønstre i elektronkonfiguration. Dette fører til forudsigelige tendenser i egenskaber, såsom atomradius, ioniseringsenergi og elektronegativitet, som alle er relateret til arrangementet af elektroner.
Kortfattet: De lignende egenskaber ved elementer i den samme gruppe skyldes i sidste ende det faktum, at de deler det samme antal valenselektroner. Denne almindelighed i elektronkonfiguration dikterer deres reaktivitet, bindingsadfærd og samlede kemiske egenskaber.
Sidste artikelHvordan reagerer alkalimetalforbindelserne på ammoniumforbindelser?
Næste artikelHvad er Lewis Dot -strukturen af HC2H3O2?
 Varme artikler
Varme artikler
-
 Håndholdt enhed kan kontrollere, om fiskeolietilskud er udløbetKredit:Plante- og fødevareforskning Fiskeoliekapsler er et populært sundhedstilskud med mange sundhedsmæssige fordele, men der er rejst bekymring over kvaliteten, fordi omega-3 fedtsyrer er meget
Håndholdt enhed kan kontrollere, om fiskeolietilskud er udløbetKredit:Plante- og fødevareforskning Fiskeoliekapsler er et populært sundhedstilskud med mange sundhedsmæssige fordele, men der er rejst bekymring over kvaliteten, fordi omega-3 fedtsyrer er meget -
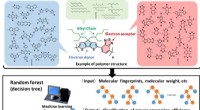 AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem)
AI-software hjælper med design af nyt materiale til solcellerFig. 1. Udforskning af nye polymerer til polymersolceller ved hjælp af materialeinformatik. (Øvre) Eksempel på en polymerstruktur bestående af elektrondonor, elektronacceptor, og alkylkæder. (Mellem) -
 Bæredygtige 3D-printede supermagneterPå Graz teknologiske universitet, miniaturiserede supermagneter blev produceret for første gang ved hjælp af laserbaseret 3D-print. Kredit:IMAT – TU Graz Fra vindmøller og elektriske motorer til s
Bæredygtige 3D-printede supermagneterPå Graz teknologiske universitet, miniaturiserede supermagneter blev produceret for første gang ved hjælp af laserbaseret 3D-print. Kredit:IMAT – TU Graz Fra vindmøller og elektriske motorer til s -
 Ultrasmå hule legeringsnanopartikler til synergistisk hydrogenudviklingskatalyseHER-polarisationskurverne for hule PtNiCu nanopartikler, kommerciel Pt/C, hule PtCoCu nanopartikler, hule PtCu nanopartikler og Cu nanopartikler i 1,0 M KOH vandig opløsning ved en scanningshastighed
Ultrasmå hule legeringsnanopartikler til synergistisk hydrogenudviklingskatalyseHER-polarisationskurverne for hule PtNiCu nanopartikler, kommerciel Pt/C, hule PtCoCu nanopartikler, hule PtCu nanopartikler og Cu nanopartikler i 1,0 M KOH vandig opløsning ved en scanningshastighed
- Anden cyklon på en uge truer Sri Lanka, Indien
- Hvem vil være milliardær? De fleste gør det ikke – hvilket er gode nyheder for planeten
- Hvordan ændrer vand Månens oprindelseshistorie?
- Forskere udskriver nanoskala billeddannelsessonde på spidsen af optisk fiber
- Hvordan svamp manipulerer frugtfluer til at hoste sporer og frigive dem
- Fysikere sporer, hvordan kontinuerlige ændringer i dimensionalitet påvirker en supervæskes kollek…


