Hvordan reagerer alkalimetalforbindelserne på ammoniumforbindelser?
reaktion:
Reaktionen mellem alkalimetalforbindelser og ammoniumforbindelser resulterer i dannelsen af ammoniakgas (NH3) , vand (H2O) , og den tilsvarende alkali metal salt .
Generel ligning:
`` `
M (OH) + NH4X → NH3 + H2O + MX
`` `
Hvor:
* m: Alkali metal (f.eks. Na, K, Li)
* OH: Hydroxidion
* NH4X: Ammoniumsalt (f.eks. NH4CL, NH4NO3)
* NH3: Ammoniakgas
* H2O: Vand
* mx: Alkali metalsalt (f.eks. NaCl, KCL, LICL)
Eksempel:
Reaktionen mellem natriumhydroxid (NaOH) og ammoniumchlorid (NH4CL) producerer ammoniakgas, vand og natriumchlorid (NaCl):
`` `
NaOH + NH4CL → NH3 + H2O + NaCl
`` `
mekanisme:
Reaktionen forekommer i to trin:
1. Protonoverførsel: Hydroxidionen fra alkalimetalforbindelsen angriber ammoniumionen fra ammoniumforbindelsen, fjerner en proton (H+) og danner vand.
2. Ammoniakdannelse: Den resterende ammoniumion (NH3+) mister en anden proton til dannelse af ammoniakgas.
Observationer:
* Reaktionen ledsages ofte af frigivelsen af en skarp lugt, der er karakteristisk for ammoniakgas.
* Hvis reaktionen udføres i et lukket system, øges trykket inde i systemet på grund af dannelsen af ammoniakgas.
Ansøgninger:
Denne reaktion bruges i forskellige applikationer, herunder:
* Produktion af ammoniak: Denne reaktion kan bruges til at producere ammoniakgas i laboratoriet.
* analyse af ammoniumforbindelser: Reaktionen kan bruges til at detektere og kvantificere ammoniumforbindelser i prøver.
* Fjernelse af ammoniak fra spildevand: Denne reaktion kan bruges til at fjerne ammoniak fra spildevand ved at reagere den med et alkalimetalhydroxid.
Sikkerhedsforholdsregler:
* Ammoniakgas er giftig og kan være skadelig, hvis den inhaleres.
* Reaktionen kan være eksoterm og kan producere varme.
* Håndter altid alkalimetalforbindelser og ammoniumforbindelser med omhu og bær passende sikkerhedsudstyr.
 Varme artikler
Varme artikler
-
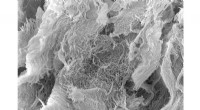 Hydrogel med langsom frigivelse hjælper immunterapi mod kræftEn syntetisk, injicerbar hydrogel udviklet ved Rice University øgede toksiciteten af en ny klasse af kræftbekæmpende immunterapimedicin. Dette scanningselektronmikroskopibillede viser de selvsamlede
Hydrogel med langsom frigivelse hjælper immunterapi mod kræftEn syntetisk, injicerbar hydrogel udviklet ved Rice University øgede toksiciteten af en ny klasse af kræftbekæmpende immunterapimedicin. Dette scanningselektronmikroskopibillede viser de selvsamlede -
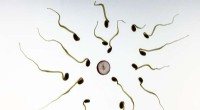 Ny metode til at opdage og visualisere sædceller genvundet fra retsmedicinsk bevisKredit:CC0 Public Domain En af de mest værdifulde former for retsmedicinsk bevismateriale i tilfælde af mandlige begåede seksuelle overgreb er tilstedeværelsen af sæd, enten i form af pletter ef
Ny metode til at opdage og visualisere sædceller genvundet fra retsmedicinsk bevisKredit:CC0 Public Domain En af de mest værdifulde former for retsmedicinsk bevismateriale i tilfælde af mandlige begåede seksuelle overgreb er tilstedeværelsen af sæd, enten i form af pletter ef -
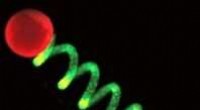 Protoceller springer i gangProtocelle-baseret mikroaktuator; enkelte gigantiske protoceller (røde) ses fastgjort i begge ender af en mekanisk energiforsynet hydrogelfilament (grøn) Naturkemi (2021). Doi:10.1038/s41557-021-007
Protoceller springer i gangProtocelle-baseret mikroaktuator; enkelte gigantiske protoceller (røde) ses fastgjort i begge ender af en mekanisk energiforsynet hydrogelfilament (grøn) Naturkemi (2021). Doi:10.1038/s41557-021-007 -
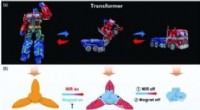 Magnetisk styret, hydrogelbaserede smarte transformerea) Billeder, der viser en transformers formtransformation. b) Formtransformationsprocessen for en blød hydrogeltransformator under koblingen af magnetfelt og NIR. c) SEM -billederne af HG -Fe3O4 -hy
Magnetisk styret, hydrogelbaserede smarte transformerea) Billeder, der viser en transformers formtransformation. b) Formtransformationsprocessen for en blød hydrogeltransformator under koblingen af magnetfelt og NIR. c) SEM -billederne af HG -Fe3O4 -hy
- Video:Sådan slår du krydret pebervarme (tip:mælk er ikke den bedste)
- Hvad er sammensætningen af krom og nikkel i rustfrit stål 316?
- Hvad kan du sige om livets eksistens og mangfoldighed inden dannelse af ozonlag?
- Efter et år med Zoom-møder, godt nødt til at genopbygge tilliden gennem øjenkontakt
- Hvad månen er ikke lavet af?
- Eleven bruger big data til at undersøge den globale digitale kønsforskel


