En base er et stof, der danner hydroxidioner i vandopløsning.?
* sand :Baser do Form hydroxidioner (OH-), når det opløses i vand. Dette er det definerende egenskab ved Arrhenius -baser.
* ikke helt sandt :Der er andre definitioner af baser, der strækker sig ud over kun hydroxidiondannelse. For eksempel beskriver Brønsted-Lowry-definitionen baser som proton (H+) acceptorer. Dette betyder, at en base også kan danne hydroxidioner ved at reagere med vand, men det behøver ikke.
Kortfattet:
* Arrhenius baser :Form hydroxidioner (OH-) i vand.
* Brønsted-lowry baser :Accepter protoner (H+), som kan omfatte reaktion med vand til dannelse af hydroxidioner.
Det er vigtigt at forstå begge definitioner for et komplet billede af basekemi.
 Varme artikler
Varme artikler
-
 Nye klæbende og termisk stabile epoxyharpikserKredit:Kansai University Epoxyharpikser eller epoxyer er organiske forbindelser, der kan hærdes til klæbende materialer med fremragende termisk stabilitet, mekanisk styrke, og kemisk resistens. Hæ
Nye klæbende og termisk stabile epoxyharpikserKredit:Kansai University Epoxyharpikser eller epoxyer er organiske forbindelser, der kan hærdes til klæbende materialer med fremragende termisk stabilitet, mekanisk styrke, og kemisk resistens. Hæ -
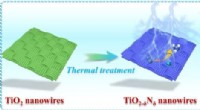 Overfladedefektkonstruktion af nanowire-arrays mod effektiv nitrogenreduktion til ammoniaksynteseKatalysatorerne er baseret på TiO2−δ Nδ nanotråde dyrket på kulstof har et højere udbytte for ammoniak end elektrokatalysatoren uden N-doping. Kredit:Journal of Energy Chemistry Ammoniak er en kul
Overfladedefektkonstruktion af nanowire-arrays mod effektiv nitrogenreduktion til ammoniaksynteseKatalysatorerne er baseret på TiO2−δ Nδ nanotråde dyrket på kulstof har et højere udbytte for ammoniak end elektrokatalysatoren uden N-doping. Kredit:Journal of Energy Chemistry Ammoniak er en kul -
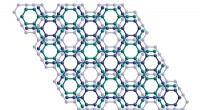 Langhypoteseret næste generations vidundermateriale skabt for første gangKrystalstrukturen af et lag af grafyn. Kredit:Yiming Hu I over et årti har forskere forsøgt at syntetisere en ny form for kulstof kaldet grafyn med begrænset succes. Den bestræbelse er dog nu ved
Langhypoteseret næste generations vidundermateriale skabt for første gangKrystalstrukturen af et lag af grafyn. Kredit:Yiming Hu I over et årti har forskere forsøgt at syntetisere en ny form for kulstof kaldet grafyn med begrænset succes. Den bestræbelse er dog nu ved -
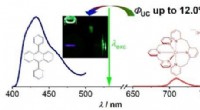 En ny vej til bæredygtig fotonopkonvertering med ikke-ædelmetallerDen molekylære rubin [Cr(bpmp)2 ]3+ med en jordrig chrom(III) central ion sensibiliserer grøn-til-blå triplet-triplet annihilation opkonvertering med 9,10-diphenylanthracen som annihilator. Processen
En ny vej til bæredygtig fotonopkonvertering med ikke-ædelmetallerDen molekylære rubin [Cr(bpmp)2 ]3+ med en jordrig chrom(III) central ion sensibiliserer grøn-til-blå triplet-triplet annihilation opkonvertering med 9,10-diphenylanthracen som annihilator. Processen


