Hvordan ser Bohrs model af atomet ud?
* kerne i centrum: Ligesom solen indeholder kernen protoner og neutroner, hvilket giver atomet sin positive ladning og det meste af sin masse.
* elektroner i kredsløb: Elektroner kredserer kernen på specifikke, cirkulære stier kaldet "energiniveau" eller "skaller." Disse kredsløb er kvantiseret, hvilket betyder, at elektroner kun kan eksistere i visse diskrete afstande fra kernen.
* Energiniveau: Hvert energiniveau har en bestemt energi forbundet med det. Elektroner i højere energiniveau er længere væk fra kernen og har mere energi.
* Elektronhopp: Elektroner kan hoppe mellem energiniveauet ved at absorbere eller udsende energi. Når en elektron absorberer energi (f.eks. Fra lys), flytter det til et højere energiniveau. Når det mister energi (f.eks. Ved at udsende lys), flytter den til et lavere energiniveau.
Her er en enkel måde at visualisere det på:
Forestil dig en lille sol i midten, der repræsenterer kernen. Forestil dig derefter planeter, der kredser om denne sol på specifikke, faste afstande. Disse planeter repræsenterer de elektroner, der kredser om kernen i deres respektive energiniveau.
Begrænsninger af Bohrs model:
Mens Bohrs model var et betydeligt skridt fremad med at forstå atomstrukturen, har den nogle begrænsninger:
* Forkerte elektronstier: Elektroner kredserer faktisk ikke kernen på perfekt cirkulære stier. Deres bevægelse er mere kompleks og beskrevet af sandsynlighedsskyer.
* mislykkes for større atomer: Bohrs model fungerer godt til brint, men den forudsiger ikke nøjagtigt opførsel af elektroner i atomer med flere elektroner.
moderne forståelse af atomet:
Den aktuelle forståelse af atomet er baseret på den kvantemekaniske model, der giver en mere nøjagtig og kompleks beskrivelse af elektronadfærd. Bohrs model er dog stadig et værdifuldt værktøj til at visualisere atomets grundlæggende struktur.
Sidste artikelForbruges enzymer i en kemisk reaktion?
Næste artikelEn base er et stof, der danner hydroxidioner i vandopløsning.?
 Varme artikler
Varme artikler
-
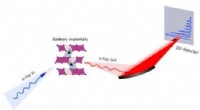 Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e
Overbygningens rolle i førstegangsspændingstab i lithium-ion-batterierFigur 1. Den typiske konfiguration af et RIXS-eksperiment. Indkommende røntgenstråler med høj energiopløsning skinner på prøverne, og de spredte røntgenstråler opløses i energi og bliver opsamlet af e -
 Opdager den næste generation af katalysatorerProfessor Jan Rossmeisl Ved hjælp af to ph.d. -studerende Jack K. Pedersen og Thomas A.A. Batchelor. Kredit:Københavns Universitet Brugen af solenergi og vindenergi skal fordobles for at imødeko
Opdager den næste generation af katalysatorerProfessor Jan Rossmeisl Ved hjælp af to ph.d. -studerende Jack K. Pedersen og Thomas A.A. Batchelor. Kredit:Københavns Universitet Brugen af solenergi og vindenergi skal fordobles for at imødeko -
 MRI-scanning hjælper med næste generations batteridesignKredit:CC0 Public Domain Magnetisk resonansbilleddannelse (MRI) kan give en effektiv måde at understøtte udviklingen af den næste generation af højtydende genopladelige batterier, ifølge forskni
MRI-scanning hjælper med næste generations batteridesignKredit:CC0 Public Domain Magnetisk resonansbilleddannelse (MRI) kan give en effektiv måde at understøtte udviklingen af den næste generation af højtydende genopladelige batterier, ifølge forskni -
 Beskyttelse af natriummetalanoder møder in situ fotoelektronspektroskopiSpecialdesignet flerkammersystem med karakteriseringer af ultraviolet fotoelektronspektroskopi (UPS) og røntgenfotoelektronspektroskopi (XPS). Nøgleresultater af dette arbejde. Kredit:Yuan Liu, Xu Lia
Beskyttelse af natriummetalanoder møder in situ fotoelektronspektroskopiSpecialdesignet flerkammersystem med karakteriseringer af ultraviolet fotoelektronspektroskopi (UPS) og røntgenfotoelektronspektroskopi (XPS). Nøgleresultater af dette arbejde. Kredit:Yuan Liu, Xu Lia
- Skriv en korte noter om Spectro Chemical Series?
- Hvad er nogle typer jord i Jerusalem?
- Hvem var den første til at bevise den geocentriske teori, ikke?
- Hvorfor nogen har været på solen?
- Hvad er den fulde elektronkonfiguration af kobber plus 2 ion?
- Hvad er nettoionligningen af Na plus OH-H Cl- H2O Cl-?


