Hvorfor er de fleste faste stoffer, der er tættere end væsker ved det samme stuetemperatur?
* solid struktur: I faste stoffer er molekyler tæt pakket i et regelmæssigt, gentagne mønster kaldet et krystalgitter. De har meget begrænset frihed til at bevæge sig. Denne tæt pakning fører til en høj densitet.
* væskestruktur: I væsker er molekyler tættere sammen end i gasser, men de har mere frihed til at bevæge sig rundt. De er ikke i et fast mønster som faste stoffer. Molekylerne kan glide forbi hinanden, så væsker kan flyde. Dette løsere arrangement resulterer i en lavere densitet sammenlignet med faste stoffer.
* Undtagelser: Der er nogle undtagelser fra denne regel. For eksempel er vand mindre tæt som en solid (is) end som en væske. Dette skyldes, at hydrogenbindingerne mellem vandmolekyler i is skaber en mere åben, mindre tæt struktur.
nøglepunkter at huske:
* Densitet er masse pr. Enhedsvolumen.
* Tæt pakket molekyler =højere densitet.
* Arrangementet af molekyler spiller en afgørende rolle i densitet.
Sidste artikelForklar hvad en kemisk ændring er?
Næste artikelHvad er kemi, og hvad i dine daglige liv?
 Varme artikler
Varme artikler
-
 Kemiundervisning går onlineKredit:CC0 Public Domain Med gymnasier og universiteter rundt om i verden lukket på grund af COVID-19-pandemien, kemilærere navigerer skiftet til online læring. Der er flere faktorer, der skal ove
Kemiundervisning går onlineKredit:CC0 Public Domain Med gymnasier og universiteter rundt om i verden lukket på grund af COVID-19-pandemien, kemilærere navigerer skiftet til online læring. Der er flere faktorer, der skal ove -
 Gigt, opdagelse af autoimmun sygdom kan føre til nye behandlingerHubert Yin i sit laboratorium på BioFrontiers Institute. Kredit:Glenn Asakawa/CU Boulder Mere end 23,5 millioner amerikanere lider af autoimmune sygdomme som reumatoid arthritis, sklerodermi og lu
Gigt, opdagelse af autoimmun sygdom kan føre til nye behandlingerHubert Yin i sit laboratorium på BioFrontiers Institute. Kredit:Glenn Asakawa/CU Boulder Mere end 23,5 millioner amerikanere lider af autoimmune sygdomme som reumatoid arthritis, sklerodermi og lu -
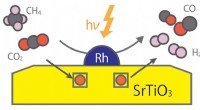 Miljøvenlig katalysator til omdannelse af metan til nyttige gasser ved hjælp af lys i stedet for v…Strontiumtitanat kombineret med rhodiumnanopartikler omdannede metan og kuldioxid til syntesegas under lysbestråling ved meget lavere temperaturer end dem, der kræves i termiske reaktorer. Kredit:Toky
Miljøvenlig katalysator til omdannelse af metan til nyttige gasser ved hjælp af lys i stedet for v…Strontiumtitanat kombineret med rhodiumnanopartikler omdannede metan og kuldioxid til syntesegas under lysbestråling ved meget lavere temperaturer end dem, der kræves i termiske reaktorer. Kredit:Toky -
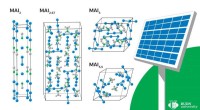 Kemiker udvikler teknik til forbedring af solcellerKredit:RUDN University En kemiker ved RUDN-universitetet har opdaget fire nye stabile forbindelser, der kan opnås ved omsætning af jod med methylammoniumiodid-brugen af disse stoffer tillader pr
Kemiker udvikler teknik til forbedring af solcellerKredit:RUDN University En kemiker ved RUDN-universitetet har opdaget fire nye stabile forbindelser, der kan opnås ved omsætning af jod med methylammoniumiodid-brugen af disse stoffer tillader pr
- Ny kvantesensorteknik muliggør kernemagnetisk resonansspektroskopi i høj opløsning
- I klassisk og kvantesikker kommunikation er praktisk tilfældighed ufuldstændig
- Hvordan er gas fra Bunsen Burn Transport til at levere brænder?
- Forskere udvikler lysdrevne motorer til at drive fremtidens nanorobotter
- Funktioner, der har en meget høj højde og undertiden er dækket af sne?
- 28 Opfindelser af den industrielle revolution


