Hvis et atom indeholder 17 protoner og 7 valenselektroner, hvad kan du bestemme om elementerne dens niveauer af reaktivitet?
1. Identificering af elementet:
* Protoner bestemmer atomnummeret: Et atom med 17 protoner er klor (CL).
2. Forståelse af valenselektroner:
* Valenselektroner er i den yderste skal: Dette er de elektroner, der er involveret i kemisk binding. Klor har 7 valenselektroner.
3. Reaktivitet og oktetreglen:
* Octet -reglen: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af 8 valenselektroner (undtagen for brint og helium, som kun har brug for 2).
* klorens ønske om stabilitet: Da klor har 7 valenselektroner, har det kun brug for en mere for at opnå en stabil oktet. Dette gør det meget reaktivt.
4. Chlorens reaktivitet:
* tendens til at få elektroner: Klor får let et elektron til dannelse af en negativt ladet ion (CL⁻). Dette gør det til en stærk ikke-metal.
* stærkt oxidationsmiddel: Chlor er et stærkt oxidationsmiddel, hvilket betyder, at det let accepterer elektroner fra andre atomer. Derfor bruges det som et desinfektionsmiddel og blegemiddel.
Kortfattet:
Et atom med 17 protoner og 7 valenselektroner er klor. Det er meget reaktivt på grund af dets tendens til at få et elektron for at opnå en stabil octet -konfiguration. Dette gør det til et stærkt ikke-metal og et kraftfuldt oxidationsmiddel.
 Varme artikler
Varme artikler
-
 Oprindelsen af bismag i løgKredit:American Chemical Society At hakke løg er normalt forbundet med vandige og stikkende øjne. Men efter at løgene er skåret i tern og tårerne er tørret, grøntsagsstykkerne kan nogle gange udvi
Oprindelsen af bismag i løgKredit:American Chemical Society At hakke løg er normalt forbundet med vandige og stikkende øjne. Men efter at løgene er skåret i tern og tårerne er tørret, grøntsagsstykkerne kan nogle gange udvi -
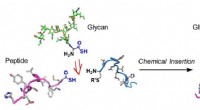 En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule
En vindende kombination til glykoproteinsynteseGlycoproteinsyntese ved kemisk indsættelse ved hjælp af en thiosyremedieret strategi:Metoden samler et fuldt glycoproteinsegment i to trin. Kredit:Osaka University Mange processer i kroppen regule -
 Opskalering af tannin-varmtvandsudvindingKredit:BBEPP Rehap kortlagde for nylig den rigelige forsyning af skovbrugsaffald i Europa, og hvor det mest bæredygtigt kan hentes fra. Med denne viden, Projektstudier har forsket i den bedst egne
Opskalering af tannin-varmtvandsudvindingKredit:BBEPP Rehap kortlagde for nylig den rigelige forsyning af skovbrugsaffald i Europa, og hvor det mest bæredygtigt kan hentes fra. Med denne viden, Projektstudier har forsket i den bedst egne -
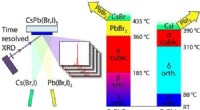 Højtydende solceller:Fysikere dyrker stabile perovskitlagKredit:ACS Krystallinske perovskitceller er nøglen til banebrydende tyndfilmsolceller. Selvom de allerede opnår meget høje effektivitetsniveauer i laboratoriet, kommercielle anvendelser er hæmmet
Højtydende solceller:Fysikere dyrker stabile perovskitlagKredit:ACS Krystallinske perovskitceller er nøglen til banebrydende tyndfilmsolceller. Selvom de allerede opnår meget høje effektivitetsniveauer i laboratoriet, kommercielle anvendelser er hæmmet
- Sådan bygger du en klimabestandig vandforsyning
- Sådan løser du magnetiske nano-knuder
- Video:Hvordan kemi gør fjernelse af kuldioxid mulig
- Den offentlige mening om GMO'er kan påvirke lignende teknologier i butikkerne
- Californien overvejer, hvordan man regulerer førerløse biler (Opdatering 2)
- Krystal med et twist:forskere dyrker spiralt nyt materiale


