Når afbalancering af en kemisk ligning er der tilladt at justere?
Her er hvorfor:
* Koefficienter repræsenterer antallet af mol af hver reaktant og produkt. Ændring af koefficienten ændrer antallet af molekyler eller mol involveret i reaktionen.
* underskrifter i en kemisk formel repræsenterer antallet af atomer i hvert element i et molekyle. Du kan ikke Skift underskrifter, fordi det ville ændre identiteten af selve stoffet.
for eksempel:
Overvej den ubalancerede ligning:
`` `
H₂ + O₂ → H₂O
`` `
For at afbalancere dette justerer vi koefficienterne:
`` `
2H₂ + O₂ → 2H₂O
`` `
Forklaring:
* starttilstand: 2 hydrogenatomer til venstre, 2 iltatomer til venstre og 2 hydrogenatomer og 1 iltatom til højre.
* afbalanceret tilstand: 4 hydrogenatomer og 2 iltatomer på begge sider.
Ved at justere koefficienterne sikrer vi, at antallet af atomer i hvert element er det samme på begge sider af ligningen, hvilket tilfredsstiller loven om bevarelse af masse.
Sidste artikelHvilket projekt er det bedste inden for kemi?
Næste artikelHvordan bruger kemikere den videnskabelige metode?
 Varme artikler
Varme artikler
-
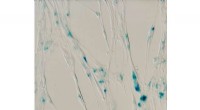 Celler holder op med at dele sig, når dette gen går i højt gear, undersøgelse finderÆldrende celler under et mikroskop. Cellerne - humane lungefibroblaster - blev ældre, efter at de eller nærliggende celler blev gensplejset til at øge aktiviteten af CD36-genet. Områder farvet med b
Celler holder op med at dele sig, når dette gen går i højt gear, undersøgelse finderÆldrende celler under et mikroskop. Cellerne - humane lungefibroblaster - blev ældre, efter at de eller nærliggende celler blev gensplejset til at øge aktiviteten af CD36-genet. Områder farvet med b -
 Udvikling af forenklet ny massespektrometrisk teknik ved brug af laser og grafenFormand-professor Dae Won Moon i Institut for Ny Biologi (til venstre) og forskningsstipendiat Jae Young Kim i Institut for Robotteknologi (til højre) Kredit:DGIST En teknologi, der kan opnå høj o
Udvikling af forenklet ny massespektrometrisk teknik ved brug af laser og grafenFormand-professor Dae Won Moon i Institut for Ny Biologi (til venstre) og forskningsstipendiat Jae Young Kim i Institut for Robotteknologi (til højre) Kredit:DGIST En teknologi, der kan opnå høj o -
 Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In
Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In -
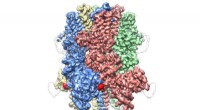 Cryo-EM afslører kronelignende struktur af protein, der er ansvarlig for at regulere blodgennemstrø…Human TRPM4 bundet med agonisten Ca+ og modulator DVT ved 3,8 Å. Kredit:Wei Lü, Ph.D. Et hold ledet af forskere ved Van Andel Research Institute (VARI) har for første gang afsløret strukturen på a
Cryo-EM afslører kronelignende struktur af protein, der er ansvarlig for at regulere blodgennemstrø…Human TRPM4 bundet med agonisten Ca+ og modulator DVT ved 3,8 Å. Kredit:Wei Lü, Ph.D. Et hold ledet af forskere ved Van Andel Research Institute (VARI) har for første gang afsløret strukturen på a


