Hvad er gruppens rækkefølge af alkalimetaller ved reaktion?
* Faldende ioniseringsenergi: Den yderste elektron er lettere at fjerne, når du går ned i gruppen, fordi elektronet er længere væk fra kernen og afskærmet af flere indre elektronskaller.
* stigende atomradius: Den større størrelse af atomer længere nede i gruppen gør det lettere for dem at miste deres valenselektron.
Her er rækkefølgen af reaktivitet af alkalimetaller fra mindst til de fleste reaktive:
1. lithium (Li)
2. natrium (NA)
3. kalium (k)
4. rubidium (RB)
5. cesium (CS)
6. francium (fr)
Vigtig note: Francium er radioaktiv og ekstremt sjælden, så dens reaktivitet observeres ikke let.
Eksempler på reaktivitet:
* lithium: Reagerer langsomt med koldt vand.
* natrium: Reagerer kraftigt med koldt vand og producerer brintgas.
* kalium: Reagerer voldsomt med koldt vand, og antænder brintgassen produceret.
* Rubidium og Cesium: Reagere eksplosivt med koldt vand.
Denne reaktivitetstrend er en nøgleegenskab ved alkalimetaller, hvilket gør dem nyttige i forskellige anvendelser som batterier, organisk kemi og farmaceutiske stoffer.
Sidste artikelHvilken ædel gas er isoelektronisk for ilt?
Næste artikelHvilket metal er meget reaktivt og holdes under olie?
 Varme artikler
Varme artikler
-
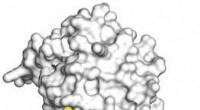 Krystalstruktur afslører, hvordan curcumin hæmmer kræftEt 3D billede, opnået ved hjælp af røntgenkrystallografi, viser curcumin i gul og rød binding til kinase-enzym dual-specificity tyrosin-reguleret kinase 2 (DYRK2) i hvidt på atomniveau. Kredit:UC San
Krystalstruktur afslører, hvordan curcumin hæmmer kræftEt 3D billede, opnået ved hjælp af røntgenkrystallografi, viser curcumin i gul og rød binding til kinase-enzym dual-specificity tyrosin-reguleret kinase 2 (DYRK2) i hvidt på atomniveau. Kredit:UC San -
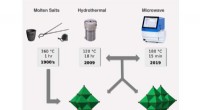 Energilagringsmaterialer bygget af molekylære blokke i nanostørrelseOversigt over forskellige fremgangsmåder til fremstilling af niobium- og tantalpolyoxometalationer og hvornår de blev rapporteret. Kredit:Tilpasset fra Rambaran et al. Molekyler af det sjældne meta
Energilagringsmaterialer bygget af molekylære blokke i nanostørrelseOversigt over forskellige fremgangsmåder til fremstilling af niobium- og tantalpolyoxometalationer og hvornår de blev rapporteret. Kredit:Tilpasset fra Rambaran et al. Molekyler af det sjældne meta -
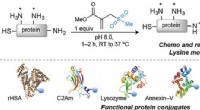 Sådan udløser en kemisk kædereaktionSkræddersyede proteinlægemidler i kampen mod kræft og andre sygdomme er et skridt tæt på, med Center for NanoScale Science and Technology på Flinders, der spiller en rolle i en af de nyeste kemifund
Sådan udløser en kemisk kædereaktionSkræddersyede proteinlægemidler i kampen mod kræft og andre sygdomme er et skridt tæt på, med Center for NanoScale Science and Technology på Flinders, der spiller en rolle i en af de nyeste kemifund -
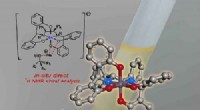 Galliumbaseret opløsningsmiddel analyserer effektivt optisk aktive alkoholerFigur:Skematisk afbildning af in-situ direkte 1H NMR chiral analyse. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Et KAIST-forskerhold har udviklet et galliumbaseret metalkomp
Galliumbaseret opløsningsmiddel analyserer effektivt optisk aktive alkoholerFigur:Skematisk afbildning af in-situ direkte 1H NMR chiral analyse. Kredit:Korea Advanced Institute of Science and Technology (KAIST) Et KAIST-forskerhold har udviklet et galliumbaseret metalkomp
- Hvorfor væsker skifter volumen, men gasser kan?
- Hvad synes den amerikanske offentlighed egentlig om AI?
- Indonesiens 'blå kulstofkreditter' er afgørende for den globale klimareduktion. Sådan hjælper du…
- Hvad er Ra-guden af?
- Tungsten isotop hjælper med at studere, hvordan man panser fremtidige fusionsreaktorer
- Det nordøstlige højeste bjerg registrerer vindstød på 171 mph


