Hvor mange molekyler i alt har NF3 omkring det centrale atom?
1. Lewis -struktur:
* nitrogen (n): 5 Valenselektroner
* fluor (F): 7 valenselektroner hver
Samlede valenselektroner: 5 + (3 * 7) =26
* Placer nitrogenatomet i midten, da det er mindre elektronegativt end fluor.
* Omgiv nitrogen med tre fluoratomer.
* Fuldfør oktetet for hvert fluoratom ved hjælp af enkeltbindinger og ensomme par.
* Nitrogen har et ensomt par.
2. Molekylær geometri:
* Det centrale nitrogenatom har tre bindingspar og et ensomt par.
* Dette svarer til en tetrahedral elektrongeometri (fire elektrongrupper).
* På grund af det ensomme par er den molekylære geometri trigonal pyramidal .
3. Konklusion:
Det centrale nitrogenatom i NF₃ har fire elektrongrupper , inklusive tre bindingspar (molekyler) og et ensomt par.
Sidste artikelHvad er den molekylære struktur af jern?
Næste artikelMakromolekyle fremstillet hovedsageligt af kulstof- og brintatomer?
 Varme artikler
Varme artikler
-
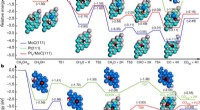 Brug af platin-molybdæncarbid til katalytisk at frigive brint til at drive en brændselscelleReaktionsvej for brintproduktion fra methanol og vand. Kredit:(c) Natur (2017). DOI:10.1038/nature21672 (Phys.org) - Et team af forskere fra flere institutioner i Kina og USA har udviklet en måd
Brug af platin-molybdæncarbid til katalytisk at frigive brint til at drive en brændselscelleReaktionsvej for brintproduktion fra methanol og vand. Kredit:(c) Natur (2017). DOI:10.1038/nature21672 (Phys.org) - Et team af forskere fra flere institutioner i Kina og USA har udviklet en måd -
 Den kemiske udvikling af DNA og RNA på den tidlige JordDe grundlæggende bestanddele af de tidligste RNA-molekyler kan være dannet i et geotermisk miljø, sådan set her i Yellowstone National Park i Wyoming. Foto:picture alliance / Mint Images RNA var s
Den kemiske udvikling af DNA og RNA på den tidlige JordDe grundlæggende bestanddele af de tidligste RNA-molekyler kan være dannet i et geotermisk miljø, sådan set her i Yellowstone National Park i Wyoming. Foto:picture alliance / Mint Images RNA var s -
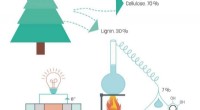 Lignin – et supergrønt brændstof til brændselscellerKredit:Linköping Universitet Forskere fra Laboratory of Organic Electronics ved Linköpings Universitet har udviklet en brændselscelle, der bruger lignin, et billigt biprodukt fra papirfremstilling
Lignin – et supergrønt brændstof til brændselscellerKredit:Linköping Universitet Forskere fra Laboratory of Organic Electronics ved Linköpings Universitet har udviklet en brændselscelle, der bruger lignin, et billigt biprodukt fra papirfremstilling -
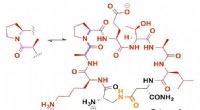 At lave en beeline forbi blod-hjerne-barrieren til medicinafgivelseMiniAp-4, vist her, kunne hjælpe med at færge medicin gennem blod-hjernebarrieren til behandling af sygdomme i centralnervesystemet. Kredit:Giralt lab De fleste lægemidler kan ikke komme igennem b
At lave en beeline forbi blod-hjerne-barrieren til medicinafgivelseMiniAp-4, vist her, kunne hjælpe med at færge medicin gennem blod-hjernebarrieren til behandling af sygdomme i centralnervesystemet. Kredit:Giralt lab De fleste lægemidler kan ikke komme igennem b
- Er kork en grundstofforbindelse heterogen blanding eller homogen blanding?
- Hvad er accelerationen af en raket ved start?
- Sådan beskytter du gymnaster mod farlige kemikalier i fitnessfaciliteter
- De vigtigste skovbrande i Portugal under kontrol (opdatering)
- Billig, bærbar detektor identificerer patogener på få minutter
- Hvad er de tre måder, en nation kan vokse på?


