Hvorfor er triethylamin opløselig i vand?
Her er hvorfor:
* Polaritet: Vand er et meget polært opløsningsmiddel på grund af dets hydrogenbinding. Triethylamin er et ikke-polært molekyle, da de tre ethylgrupper (CH3CH2-) fastgjort til nitrogenatomet fordeler elektrondensiteten jævnt. Denne forskel i polaritet fører til dårlig interaktion mellem de to molekyler.
* Hydrogenbinding: Vandmolekyler kan danne stærke brintbindinger med hinanden. Triethylamin, der mangler et hydrogenatom bundet til et elektronegativt atom, kan ikke deltage i hydrogenbinding med vand.
* Hydrofob effekt: De ikke-polære ethylgrupper i triethylamin interagerer positivt med hinanden, hvilket skaber en hydrofob "skal", der modstår interaktion med vand.
Sammenfattende bidrager manglen på polaritet, manglende evne til at danne hydrogenbindinger og hydrofobe effekt alle til den dårlige opløselighed af triethylamin i vand.
Sidste artikelEr kuldioxid lettere end helium?
Næste artikelOpløses alle faste og flydende i hinanden?
 Varme artikler
Varme artikler
-
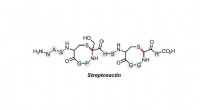 Lab opdager et lille Cain-and-Abel-molekyleStrukturen af det nyopdagede lille molekyle Streptosactin. Kredit:Leah Bushin. Et nyt bakteriemolekyle med den usmagelige tendens til at opspore og dræbe andre af sin egen art er blevet opdaget
Lab opdager et lille Cain-and-Abel-molekyleStrukturen af det nyopdagede lille molekyle Streptosactin. Kredit:Leah Bushin. Et nyt bakteriemolekyle med den usmagelige tendens til at opspore og dræbe andre af sin egen art er blevet opdaget -
 Her er et twist til en ældgammel klassiker:Laktosefri chokolademælkTo nordøstlige kandidater har bragt skifer, deres mærke af laktosefri chokolademælk, på hylderne i mere end 300 dagligvarebutikker langs østkysten. Kredit:Matthew Modoono/Northeastern University F
Her er et twist til en ældgammel klassiker:Laktosefri chokolademælkTo nordøstlige kandidater har bragt skifer, deres mærke af laktosefri chokolademælk, på hylderne i mere end 300 dagligvarebutikker langs østkysten. Kredit:Matthew Modoono/Northeastern University F -
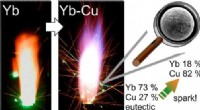 Forskere bruger sjældne jordarters metaller i legeringspulvere til at producere grønne, iøjnefald…Grafisk abstrakt. Kredit:ACS Omega (2022). DOI:10.1021/acsomega.2c03081 Stjernekastere kan være meget sjove - glimtende, brusende og spyttede lysbuer ud fra håndholdte pinde eller rør på jorden. Me
Forskere bruger sjældne jordarters metaller i legeringspulvere til at producere grønne, iøjnefald…Grafisk abstrakt. Kredit:ACS Omega (2022). DOI:10.1021/acsomega.2c03081 Stjernekastere kan være meget sjove - glimtende, brusende og spyttede lysbuer ud fra håndholdte pinde eller rør på jorden. Me -
 Årsager til beton- og asfaltforringelse forklaretEt nærbillede af en bro, viser forringet asfaltbelægning og beton. Kredit:Akihiro Moriyoshi Forskere har afsløret, at forringelsen af moderne beton- og asfaltstrukturer skyldes tilstedeværelsen
Årsager til beton- og asfaltforringelse forklaretEt nærbillede af en bro, viser forringet asfaltbelægning og beton. Kredit:Akihiro Moriyoshi Forskere har afsløret, at forringelsen af moderne beton- og asfaltstrukturer skyldes tilstedeværelsen
- Hvad var de første organismer, der boede på en klippe?
- At bringe studerende tættere på eksplosive solarrangementer
- Hvorfor kviksølv er farligere i havene
- Hvordan bruger et solcellepanel lys?
- Data mining syndromer
- Verdens sydligste træ vokser på et af de mest blæsende steder på jorden, men klimaforandringerne…


