Hvordan forudsiger du typen af binding mellem to atomer?
1. Forstå det grundlæggende:
* ioniske bindinger: Forekommer mellem et metal og en ikke -metal. Metaller har en tendens til at miste elektroner til dannelse af positive ioner (kationer), mens ikke -metaller får elektroner til dannelse af negative ioner (anioner). Den elektrostatiske tiltrækning mellem modsat ladede ioner danner den ioniske binding.
* kovalente obligationer: Forekommer mellem to ikke -metaller. Begge atomer deler elektroner for at opnå en stabil elektronkonfiguration.
* Metalliske obligationer: Forekommer mellem metalatomer. Elektroner delokaliseres, hvilket betyder, at de bevæger sig frit gennem metalgitteret og skaber stærke attraktioner mellem metalatomer.
2. Se på elektronegativitet:
* Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner inden for en binding.
* Forskel i elektronegativitet (ΔEn):
* ΔEN> 1.7: Angiver typisk en ionisk binding.
* 0,5 <Δen <1,7: Angiver typisk en polær kovalent binding (et atom har et stærkere træk på de delte elektroner).
* ΔEn <0,5: Angiver typisk en ikke -polær kovalent binding (elektroner deles forholdsvis lige).
3. Overvej elementerne:
* Metaller: Generelt danner ioniske bindinger med ikke -metaller og metalliske bindinger med andre metaller.
* ikke -metaller: Form kovalente bindinger med andre ikke -metaller.
* metalloider (semimetaler): Kan danne bindinger med både metaller og ikke -metaller, der ofte viser egenskaber for begge typer.
4. Eksempler:
* NaCl (natriumchlorid): Na (metal) og Cl (ikke -metal) - ionisk binding (Δen =2,1).
* h₂o (vand): H (ikke -metal) og O (ikke -metal) - polær kovalent binding (Δen =1,4).
* ch₄ (metan): C (ikke -metal) og H (ikke -metal) - ikke -polær kovalent binding (Δen =0,4).
* Fe (jern): Metallisk binding.
5. Vigtige noter:
* limning er et spektrum: Linjerne mellem ioniske, polære kovalente og ikke -polære kovalente bindinger kan være slørede.
* Andre faktorer: Ting som bindingslængde og størrelsen på atomerne kan også påvirke bindetypen.
Ved at følge disse trin og i betragtning af de involverede faktorer kan du foretage rimelige forudsigelser om de typer bindinger, der dannes mellem atomer.
 Varme artikler
Varme artikler
-
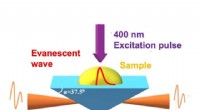 Terahertz-bølger afslører skjulte processer i ultrahurtig kunstig fotosynteseOpsætning til tidsopløst terahertz-dæmpet totalreflektion (TR-ATR) spektroskopi. Kredit:Osaka University Et team af forskere fra Osaka University, i samarbejde med Tokyo Institute of Technology, d
Terahertz-bølger afslører skjulte processer i ultrahurtig kunstig fotosynteseOpsætning til tidsopløst terahertz-dæmpet totalreflektion (TR-ATR) spektroskopi. Kredit:Osaka University Et team af forskere fra Osaka University, i samarbejde med Tokyo Institute of Technology, d -
 At bryde vandmolekyler fra hinanden for at generere rent brændstof:Undersøgelse af et lovende mate…Fotoelektrokemisk vandopdeling. Vand kan spaltes for at opnå H 2 og O. 2 ved at anvende en lav spænding i et kredsløb som det, der er vist i figuren, ved hjælp af et passende fotoanodemateriale. H
At bryde vandmolekyler fra hinanden for at generere rent brændstof:Undersøgelse af et lovende mate…Fotoelektrokemisk vandopdeling. Vand kan spaltes for at opnå H 2 og O. 2 ved at anvende en lav spænding i et kredsløb som det, der er vist i figuren, ved hjælp af et passende fotoanodemateriale. H -
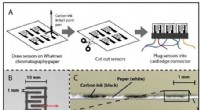 Madfriskhedssensorer kan erstatte sidste anvendelsesdatoer for at reducere madspild(A) Fremstilling af papirbaserede elektriske gassensorer (PEGS). Kulstofelektroder er trykt på WhatmanTM cellulosekromatografi 1 papir med en kuglepen og skæreplotter, tillader hurtig prototyping i de
Madfriskhedssensorer kan erstatte sidste anvendelsesdatoer for at reducere madspild(A) Fremstilling af papirbaserede elektriske gassensorer (PEGS). Kulstofelektroder er trykt på WhatmanTM cellulosekromatografi 1 papir med en kuglepen og skæreplotter, tillader hurtig prototyping i de -
 Produktionsteknologi for nye flystrukturer har øget deres styrke3D-printede kompositdele. Kredit:Sergey Gnuskov/NUST MISIS Forskere fra NUST MISIS har udviklet en metode til fremstilling af kompositdele til luftfartsindustrien, som har øget styrken af færdige
Produktionsteknologi for nye flystrukturer har øget deres styrke3D-printede kompositdele. Kredit:Sergey Gnuskov/NUST MISIS Forskere fra NUST MISIS har udviklet en metode til fremstilling af kompositdele til luftfartsindustrien, som har øget styrken af færdige
- Hvad sker der i slutningen af guiden til Galaxy?
- Tropiske skovjord fanger kulstof under forhøjet nitrogenaflejring
- Hvad ville der ske med en fødekæde, hvis populationen af én organisme steg?
- At øge offentlighedens tillid til videnskabsmænd afhænger af kommunikationsmetoder
- Hvor mange dage tager det for jorden at løse omkring solen?
- Hvor mange atomer er et molekyle sammensat af?


