Hvilken type binding er mellem metaller med ikke -metaller forskellige elektronegativiteter?
Her er hvorfor:
* Elektronegativitet: Elektronegativitet er målet for et atoms evne til at tiltrække elektroner i en binding. Ikke -metaller har generelt højere elektronegativitet end metaller.
* Elektronoverførsel: Når et metal interagerer med en ikke -metal, får den højere elektronegativitet af ikke -metalet det til at "stjæle" en eller flere elektroner fra metalatomet. Dette resulterer i dannelsen af ioner:en positivt ladet metalion (kation) og en negativt ladet ikke -metal ion (anion).
* Elektrostatisk attraktion: De modsatte ladede ioner tiltrækkes derefter af hinanden gennem stærke elektrostatiske kræfter og danner en ionisk binding.
Eksempel:
* natrium (NA) og chlor (CL): Natrium har en lav elektronegativitet, mens klor har en høj elektronegativitet. Når de reagerer, mister natrium et elektron for at blive et positivt ladet natriumion (Na+), og klor får et elektron til at blive et negativt ladet chloridion (CL-). Disse ioner danner derefter en ionisk binding til at skabe natriumchlorid (NaCl), almindeligvis kendt som tabel salt.
Sidste artikelHvilken type binding har høj elektronegativitet?
Næste artikelHvordan forudsiger du typen af binding mellem to atomer?
 Varme artikler
Varme artikler
-
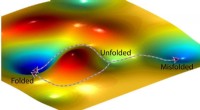 Skjult symmetri fundet i kemiske kinetiske ligningerEn kunstners repræsentation af et landskab med fri energi og to mulige veje, et protein kan følge (venstre) for at folde korrekt og en tredje vej (til højre), der fører til en fejlfoldet tilstand. Kre
Skjult symmetri fundet i kemiske kinetiske ligningerEn kunstners repræsentation af et landskab med fri energi og to mulige veje, et protein kan følge (venstre) for at folde korrekt og en tredje vej (til højre), der fører til en fejlfoldet tilstand. Kre -
 Forskere udvikler en ny enhed til screening af avancerede krystallinske materialerVenstre til højre:Meenesh R. Singh (UIC), Paria Coliaie (UIC), Manish S. Kelkar (AbbVie Inc.) og Nandkishor K. Nere (AbbVie Inc.) viser nye mikrofluidiske enheder frem. Kredit:Meenesh Singh Forske
Forskere udvikler en ny enhed til screening af avancerede krystallinske materialerVenstre til højre:Meenesh R. Singh (UIC), Paria Coliaie (UIC), Manish S. Kelkar (AbbVie Inc.) og Nandkishor K. Nere (AbbVie Inc.) viser nye mikrofluidiske enheder frem. Kredit:Meenesh Singh Forske -
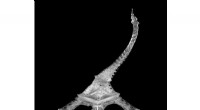 Dynamisk 3-D printproces har et lysdrevet twistDette lille Eiffeltårn blev produceret ved hjælp af en ny dynamisk 3D-printmetode, der har evnen til at ændre printretningen i farten. Kredit:Northwestern University Lysets hastighed er kommet til
Dynamisk 3-D printproces har et lysdrevet twistDette lille Eiffeltårn blev produceret ved hjælp af en ny dynamisk 3D-printmetode, der har evnen til at ændre printretningen i farten. Kredit:Northwestern University Lysets hastighed er kommet til -
 Forskere demonstrerer nye måder at opnå selektivitet for biomarkører inden for bioelektronikErin Ratcliff, venstre, og bachelorstuderende Zachary Kushlan undersøger en organisk halvleder tynd film fremstillet i Ratcliff -laboratoriet. Kredit:University of Arizona Ingeniører ved Universit
Forskere demonstrerer nye måder at opnå selektivitet for biomarkører inden for bioelektronikErin Ratcliff, venstre, og bachelorstuderende Zachary Kushlan undersøger en organisk halvleder tynd film fremstillet i Ratcliff -laboratoriet. Kredit:University of Arizona Ingeniører ved Universit
- Afskæring af skov i de sydlige Rockies kan reducere risikoen for alvorlige naturbrande:undersøgels…
- Nedstyrtende raket vil skabe et nyt månekrater:Hvad vi bør bekymre os om
- Ny algoritme finder effektivt antibiotikakandidater
- Buzz Aldrin forlader New Zealand efter evakuering af sydpolen
- Bidrager din kaffe til malariarisiko?
- Velcro-metode til mere præcis binding af lægemiddelpartikler


