Hvad er Rutherford og Marsdens nukleare model?
Rutherford og Marsdens nukleare model:En revolution i atomstruktur
Rutherford og Marsdens nukleare model, også kendt som Rutherford -modellen , var en banebrydende opdagelse, der revolutionerede vores forståelse af atomet. Det blev foreslået i 1911 efter det berømte guldfolieeksperiment .
eksperimentet:
* Ernest Rutherford og hans studerende, Hans Geiger, instruerede en stråle af alfa -partikler (positivt ladede partikler) ved en tynd guldfolie.
* De fleste af alfa -partiklerne passerede lige gennem folien, men nogle blev afbøjet i store vinkler, og et par endda sprang tilbage.
Modellen:
* Atomet er for det meste tomt rum: Det faktum, at de fleste alfa -partikler passerede gennem folien indikerede, at atomer ikke er faste kugler, som tidligere troede.
* en lille, tæt, positivt ladet kerne: Afbøjningen af nogle alfa -partikler, især dem, der sprang tilbage, antydede tilstedeværelsen af en lille, tæt, positiv ladet region i midten af atomet, som Rutherford kaldte nucleus .
* Elektroner, der kredser om kernen: Elektronerne, der er negativt ladet, kredser om afstand.
Nøglefunktioner:
* positivt ladet kerne: Kernen indeholder det meste af atomets masse og al dens positive ladning.
* negativt ladede elektroner: Elektroner kredser om kernen i en sky af negativ ladning.
* tomt rum: Langt de fleste af atomet er tomt rum.
implikationer:
* Rutherford -modellen forklarede resultaterne af guldfolieeksperimentet.
* Det gav en ny forståelse af atomstruktur, der erstattede den tidligere blommepudding -model.
* Det lagde grundlaget for yderligere udvikling af atommodeller, herunder BoHR -modellen og den kvantemekaniske model.
Begrænsninger:
* Rutherford -modellen forklarede ikke stabiliteten af atomer. Hvorfor falder ikke de negativt ladede elektroner i den positivt ladede kerne?
* Det forklarede ikke emissionen af specifikke bølgelængder af lys med atomer.
Kortfattet:
Rutherford og Marsdens nukleare model var en betydelig fremgang i vores forståelse af atomet. Det gav en ramme for fremtidige modeller, der i sidste ende ville forklare stabiliteten af atomer og arten af lysemission.
 Varme artikler
Varme artikler
-
 Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir
Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir -
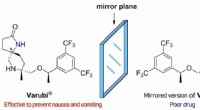 Syntetisere nyttige forbindelser uden at danne uønskede chirale partnereFigur 1 Varubi bruges sammen med anden medicin for at forhindre forsinket kvalme og opkastning forårsaget af kræftbehandling. Selvom de har de samme atomer, Varubis spejlbillede producerer ikke så meg
Syntetisere nyttige forbindelser uden at danne uønskede chirale partnereFigur 1 Varubi bruges sammen med anden medicin for at forhindre forsinket kvalme og opkastning forårsaget af kræftbehandling. Selvom de har de samme atomer, Varubis spejlbillede producerer ikke så meg -
 Forskere fanger roaming molekylære fragmenter i realtidKredit:Pixabay/CC0 Public Domain Observation af en kemisk reaktion på molekylært niveau i realtid er et centralt tema i eksperimentel kemisk fysik. Et internationalt forskerhold har for første gan
Forskere fanger roaming molekylære fragmenter i realtidKredit:Pixabay/CC0 Public Domain Observation af en kemisk reaktion på molekylært niveau i realtid er et centralt tema i eksperimentel kemisk fysik. Et internationalt forskerhold har for første gan -
 Kemikere skaber kunstigt protein, der kigger ind i Jordens kemiske fortidKredit:Pixabay/CC0 Public Domain Forskere har udviklet et kunstigt protein, der kan give ny indsigt i den kemiske evolution på den tidlige jord. Alle celler har brug for energi for at overleve, me
Kemikere skaber kunstigt protein, der kigger ind i Jordens kemiske fortidKredit:Pixabay/CC0 Public Domain Forskere har udviklet et kunstigt protein, der kan give ny indsigt i den kemiske evolution på den tidlige jord. Alle celler har brug for energi for at overleve, me
- Atomreaktor, hvordan en fungerer
- Mere end 200 millioner amerikanere kunne have giftig PFAS i deres drikkevand
- Bare tilsæt vand:Hvordan forskerne bruger silicium til at producere brint efter behov
- Forskere afslører årsagen til, at muldvarperotter er uvidende om sure smerter
- De høje omkostninger ved perfektionisme
- Hvem er du? Squattere kan faktisk hjælpe et kvarter


