Hvorfor er forbindelser af XE mere almindelige sammenlignet med andre ædelgasser?
1. XE har den største atomradius og laveste ioniseringsenergi blandt de ædle gasser:
* atomradius: XE's større størrelse betyder, at dens ydre elektroner er længere væk fra kernen og oplever svagere tiltrækning. Dette gør dem lettere at fjerne, fremme af limning.
* ioniseringsenergi: Den nedre ioniseringsenergi betyder, at XE let mister elektroner til dannelse af kationer. Dette er en nøglefaktor i dens evne til at danne forbindelser.
2. Xe's Valence Shell er relativt tæt på energi til andre ikke -metaller:
* Energiniveauet for XE's valenselektroner er tættere på energiniveauet for stærkt elektronegative elementer som ilt og fluor. Dette muliggør dannelse af stabile kemiske bindinger.
3. Tidlige opdagelser af XE -forbindelser:
* Neil Bartlett's banebrydende opdagelse af XEPTF6 i 1962 demonstrerede muligheden for, at XE danner forbindelser, der banede vejen for yderligere forskning.
Hvorfor andre ædelgasser danner færre forbindelser:
* mindre atomradius: Han, NE og AR er for små til effektivt at interagere med andre atomer.
* Højere ioniseringsenergi: Det er meget sværere at fjerne elektroner fra disse mindre ædle gasser.
* mindre polariserbare elektronskyer: Elektronskyerne af HE, NE og AR er mindre let forvrænget, hvilket gør dem mindre tilbøjelige til at danne obligationer.
Kortfattet:
XEs unikke kombination af en relativt stor atomradius, lavere ioniseringsenergi og en valensskal tæt i energi til andre ikke -metaller giver den mulighed for at danne en bredere vifte af forbindelser sammenlignet med de andre ædle gasser.
Sidste artikelHvilket element er en ikke -reaktiv gas?
Næste artikelHvilket element er en ikke -reaktiv ædelgas?
 Varme artikler
Varme artikler
-
 Undersøgelse viser potentiale for jordvenlig plasterstatningDen nye blanding af bioplast og gummi, der blev udtænkt af forskere i Ohio State, viste sig at være meget mere holdbar end bioplasten på egen hånd Credit:Ohio State University Stræben efter at hol
Undersøgelse viser potentiale for jordvenlig plasterstatningDen nye blanding af bioplast og gummi, der blev udtænkt af forskere i Ohio State, viste sig at være meget mere holdbar end bioplasten på egen hånd Credit:Ohio State University Stræben efter at hol -
 Studiet giver mere end en million nye cykliske forbindelser, nogle med farmaceutisk potentialeUniversity of Illinois kemiprofessor Wilfred van der Donk og hans kolleger udviklede en ny metode til at generere store biblioteker af unikke cykliske forbindelser. Kredit:Don Hamerman Forskere si
Studiet giver mere end en million nye cykliske forbindelser, nogle med farmaceutisk potentialeUniversity of Illinois kemiprofessor Wilfred van der Donk og hans kolleger udviklede en ny metode til at generere store biblioteker af unikke cykliske forbindelser. Kredit:Don Hamerman Forskere si -
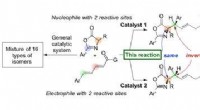 Angiv oprettelse af chiralitet ved hjælp af organiske katalysatorerNyt organokatalytisk system til selektivt at generere diastereomerer med højt udbytte og selektivitet. Kredit:Nagoya University Forskere ved Nagoya University har rapporteret i Naturkommunikation
Angiv oprettelse af chiralitet ved hjælp af organiske katalysatorerNyt organokatalytisk system til selektivt at generere diastereomerer med højt udbytte og selektivitet. Kredit:Nagoya University Forskere ved Nagoya University har rapporteret i Naturkommunikation -
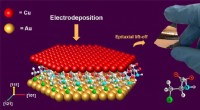 Forskere bruger aminosyrer til at dyrke højtydende kobber tynde filmKobbertynde film fremstilles ved elektroaflejring af kobber, Cu (111), på et selvsamlet organisk monolag af aminosyren L-cystein på guld, Au (111). Kredit:Bin Luo For første gang, forskere fra Mis
Forskere bruger aminosyrer til at dyrke højtydende kobber tynde filmKobbertynde film fremstilles ved elektroaflejring af kobber, Cu (111), på et selvsamlet organisk monolag af aminosyren L-cystein på guld, Au (111). Kredit:Bin Luo For første gang, forskere fra Mis
- NASA TRMM-satellitdata viser områder med Alexs kraftige nedbør
- Boeing CEO forventer stadig, at 737 MAX bliver godkendt til at flyve i år
- Hvordan sammenligner tyngdekraften accelerationen mellem objekter?
- Hvordan vokser haglsten?
- Inde i mørket, polære månekratere, vand ikke så uovervindeligt som forventet, videnskabsmænd hæ…
- Tavs kode af nukleotider, ikke aminosyrer, bestemmer funktioner af vitale proteiner


