Hvad er det samme om isotoper og atom?
* De repræsenterer begge det samme element: Isotoper er variationer af det samme element. Dette betyder, at de har det samme antal protoner, der definerer elementet.
* de har de samme kemiske egenskaber: Den kemiske opførsel af et atom bestemmes stort set af dets elektronkonfiguration. Da isotoper har det samme antal protoner, har de også det samme antal elektroner, hvilket resulterer i lignende kemisk reaktivitet.
Nøgleforskelle:
* Antal neutroner: Isotoper adskiller sig i deres antal neutroner. Det er dette, der gør dem til "isotoper" - variationer af det samme element med forskellige masser.
* atommasse: På grund af de forskellige neutronoptællinger har isotoper forskellige atommasser.
Kortfattet:
Mens isotoper er specifikke former for et atom med forskellige neutronoptællinger, deler de de grundlæggende egenskaber, der definerer elementet, som protonnummer og kemisk opførsel.
Sidste artikelHvad er det specielle ved lanthandies og actinider?
Næste artikelEr en frysende kemisk ændring?
 Varme artikler
Varme artikler
-
 Moderne alkymister gør kemien grønnereGamle alkymister forsøgte at gøre bly og andre almindelige metaller til guld og platin. Moderne kemikere i Paul Chiriks laboratorium i Princeton omdanner reaktioner, der har været afhængige af miljøve
Moderne alkymister gør kemien grønnereGamle alkymister forsøgte at gøre bly og andre almindelige metaller til guld og platin. Moderne kemikere i Paul Chiriks laboratorium i Princeton omdanner reaktioner, der har været afhængige af miljøve -
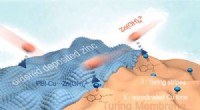 Turing-membran for at forbedre ydeevnen af zinkbaserede batterierDendritfrit zinkbaseret batteri med høj arealkapacitet udviklet via den regioninducerede aflejringseffekt af Turing-membran. Kredit:Wu Jine Zinkbaserede batterier er lovende muligheder for energil
Turing-membran for at forbedre ydeevnen af zinkbaserede batterierDendritfrit zinkbaseret batteri med høj arealkapacitet udviklet via den regioninducerede aflejringseffekt af Turing-membran. Kredit:Wu Jine Zinkbaserede batterier er lovende muligheder for energil -
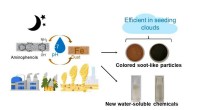 Ny kemi opstår, når støv møder forureningRepræsentation af forureningshændelser, hvor mineralstøv og biomassebrændende røg blandes. Kredit:Hind Al-Abadleh Det er en ny kemi fundet at finde sted i en skydråbe, en våd aerosol eller på overf
Ny kemi opstår, når støv møder forureningRepræsentation af forureningshændelser, hvor mineralstøv og biomassebrændende røg blandes. Kredit:Hind Al-Abadleh Det er en ny kemi fundet at finde sted i en skydråbe, en våd aerosol eller på overf -
 Røntgenlasersyn afslører lægemiddelmålKredit:Elena Khavina/MIPT Forskere fra Moskva Institut for Fysik og Teknologi har offentliggjort en anmeldelse om seriel femtosekundkrystallografi, en af de mest lovende metoder til at analysere
Røntgenlasersyn afslører lægemiddelmålKredit:Elena Khavina/MIPT Forskere fra Moskva Institut for Fysik og Teknologi har offentliggjort en anmeldelse om seriel femtosekundkrystallografi, en af de mest lovende metoder til at analysere


