Hvad produceres, når to løsninger reagerer?
1. Udfældning:
* Hvad sker der: Uopløselig fast stof (bundfald) former, ofte synlige som en uklarhed i opløsningen.
* Eksempel: Blanding af en opløsning af bly (II) nitrat (PB (NO₃) ₂) med en opløsning af kaliumiodid (KI) danner et gult bundfald af bly (II) iodid (PBI₂).
2. Gasudvikling:
* Hvad sker der: En gas frigøres, ofte observeret som bobler.
* Eksempel: Blanding af en opløsning af saltsyre (HCI) med en opløsning af natriumcarbonat (Na₂co₃) producerer kuldioxidgas (CO₂).
3. Dannelse af en ny løsning:
* Hvad sker der: Reaktanter opløses og omarrangeres for at danne nye opløste produkter.
* Eksempel: Blanding af en opløsning af natriumhydroxid (NaOH) med en opløsning af saltsyre (HCI) producerer en opløsning af natriumchlorid (NaCl) og vand (H₂O).
4. Redox -reaktioner:
* Hvad sker der: Elektroner overføres mellem reaktanter, hvilket resulterer i en ændring i oxidationstilstande.
* Eksempel: Blanding af en opløsning af jern (II) sulfat (FESO₄) med en opløsning af kaliumpermanganat (KMNO₄) under sure forhold fører til en redox -reaktion, hvor Fe²⁺ oxideres til Fe³⁺ og Mno₄⁻ reduceres til mn²⁺.
5. Ingen reaktion:
* Hvad sker der: Løsningerne kan simpelthen blande, men der opstår ingen synlig ændring eller ny produktdannelse. Dette sker, når reaktanterne ikke er reaktive med hinanden.
Vigtige overvejelser:
* reaktionstype: Typen af reaktion (f.eks. Syre-base, nedbør, redox) påvirker de dannede produkter.
* støkiometri: De relative mængder af reaktanter bestemmer mængden af de dannede produkter.
* Betingelser: Temperatur, tryk og pH kan alle påvirke resultatet af en reaktion.
For nøjagtigt at forudsige produkterne fra en reaktion skal du vide:
* identiteten af reaktanterne
* de kemiske egenskaber for reaktanterne
* Betingelserne under hvilke reaktionen finder sted
At forstå principperne for kemiske reaktioner, såsom støkiometri og kemisk kinetik, er afgørende for at forudsige resultaterne af reaktioner.
 Varme artikler
Varme artikler
-
 Nyt materiale til at overgå traditionelle oxygenreduktionsreaktionskatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. YANG Minghui ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) opdagede, at
Nyt materiale til at overgå traditionelle oxygenreduktionsreaktionskatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. YANG Minghui ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kinesiske videnskabsakademi (CAS) opdagede, at -
 Forskere foreslår ny tilgang til måling af atomerForsiden illustrerer effekten af geometribaseret filtrering af intermolekylære kontakter på deres afstandsfordeling. Linje-of-sight-princippet eliminerer effektivt baggrunden for tilfældigt fordelte
Forskere foreslår ny tilgang til måling af atomerForsiden illustrerer effekten af geometribaseret filtrering af intermolekylære kontakter på deres afstandsfordeling. Linje-of-sight-princippet eliminerer effektivt baggrunden for tilfældigt fordelte -
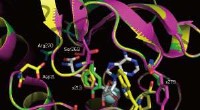 Direkte udvikling for at designe enzymer, der laver billeddannelsesmidler til medicinsk diagnoseEt nærbillede af SAM-bindingsstederne for det native enzym (gul) og to mutanter (magenta og grøn). De muterede positioner 213 og 279 er mærket. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim Org
Direkte udvikling for at designe enzymer, der laver billeddannelsesmidler til medicinsk diagnoseEt nærbillede af SAM-bindingsstederne for det native enzym (gul) og to mutanter (magenta og grøn). De muterede positioner 213 og 279 er mærket. Kredit:WILEY-VCH Verlag GmbH &Co. KGaA, Weinheim Org -
 Ny forskning optimerer både elasticitet og stivhed i det samme materiale uden de sædvanlige afvejn…Muslinger og andre indbyggere i den stenede tidevandszone har udviklet sofistikerede metoder til at klæbe til overflader på trods af bølger og vind Kredit: Kollbe Ahn I materialernes verden, stivh
Ny forskning optimerer både elasticitet og stivhed i det samme materiale uden de sædvanlige afvejn…Muslinger og andre indbyggere i den stenede tidevandszone har udviklet sofistikerede metoder til at klæbe til overflader på trods af bølger og vind Kredit: Kollbe Ahn I materialernes verden, stivh
- Hvorfor importeret grønt stadig er mere bæredygtigt end lokalt kød
- Shard afslører, hvordan Cyperns gamle kongeriger styrede økonomien
- Hvordan kan der være 1 proton med en hydrogenatommasse?
- Et barn og en cykel har kombineret masse på 45 kg Rides 1,8 m på 10 sekunder med konstant hastighe…
- Forskere arbejder på at skabe en køreplan for kvantematerialer
- Billede:Hubble-visningsstjernen nærmer sig sin afslutning


