Hvordan finder du PH på to forbindelser, der er givet sammen?
Hvorfor kan du ikke tilføje pH -værdier direkte:
* ph er en logaritmisk skala: PH måler koncentrationen af hydrogenioner (H+) i en opløsning. PH -skalaen er logaritmisk, hvilket betyder, at hvert hele antal ændringer repræsenterer en ti gange ændring i H+ -koncentration.
* Blanding af ændringer Koncentrationer: Når du blander to forbindelser, ændres deres individuelle H+ -koncentrationer. Den endelige pH afhænger af de relative mængder af hver forbindelse og deres sure eller basiske styrker.
hvordan man finder pH i en blanding:
1. Identificer forbindelserne:
* syrer: Doner H+ -ioner (f.eks. HCL, HNO3, H2SO4)
* baser: Accepter H+ ioner (f.eks. NaOH, KOH, NH3)
* neutral: Påvirk ikke markant PH (f.eks. Sukker, salt)
2. Bestem deres koncentrationer: Du skal kende de indledende molekoncentrationer af hver forbindelse i blandingen.
3. Beregn de nye koncentrationer:
* neutralisering: Hvis en syre og base er blandet, reagerer de. Beregn mængden af syre og base, der reagerer på dannelse af vand (H2O) og et salt. Dette vil påvirke de endelige koncentrationer af den resterende syre eller base.
* fortynding: Hvis du fortynder en forbindelse med vand, falder koncentrationen af forbindelsen.
4. Beregn pH:
* stærke syrer og baser: Brug følgende ligninger:
* ph =-log [H+] (for stærke syrer)
* POH =-log [OH-] (for stærke baser)
* Ph + POH =14 (for at finde pH fra POH)
* svage syrer og baser: Brug ligevægtskonstanten (KA eller KB) til syre eller base og isen (initial, ændring, ligevægt) tabelmetode til at beregne H+ eller OH-koncentrationen og derefter finde pH.
Eksempel:
Lad os sige, at du blander 50 ml 0,1 M HCI (en stærk syre) med 50 ml 0,1 M NaOH (en stærk base).
1. neutralisering: HCl og NaOH reagerer fuldstændigt i et forhold på 1:1 for at danne vand (H2O) og NaCl (salt).
2. slutkoncentrationer: Da mængderne er ens, neutraliserer syren og bunden af hinanden fuldstændigt. Den endelige opløsning vil være neutral med en pH på 7.
Nøglepunkter:
* Overvej altid styrkerne ved de involverede syrer og baser.
* Hvis du arbejder med svage syrer eller baser, er beregningerne mere komplekse.
* Hvis blandingen involverer flere syrer eller baser, skal du bruge mere avancerede ligevægtsberegninger.
Hvis du leverer specifikke forbindelser og deres koncentrationer, kan jeg hjælpe dig med at beregne blandingens pH.
Sidste artikelHvilken har en lavere entalpi ethylenoxid eller acetaldehyd?
Næste artikelHvad produceres, når to løsninger reagerer?
 Varme artikler
Varme artikler
-
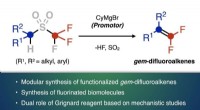 Etablering af en hurtig syntesemetode til nyttige organiske fluorforbindelserReaktionen af trifloner med det organiske magnesium-Grignard-reagens muliggør syntese af gem-difluoroalkenes Kredit:Issey Takahashi Nagoya University Institute of Transformative Bio-Molecules (W
Etablering af en hurtig syntesemetode til nyttige organiske fluorforbindelserReaktionen af trifloner med det organiske magnesium-Grignard-reagens muliggør syntese af gem-difluoroalkenes Kredit:Issey Takahashi Nagoya University Institute of Transformative Bio-Molecules (W -
 Forskere udvikler billige, høj strømtæthed vanadium flow batteri stakNy generation af vanadiumflow-batteristabelteknologi tilbyder lave omkostninger og høj effekttæthed. Kredit:SHI Dingqin Udviklingen af vedvarende energikilder såsom vind- og solenergi er begræns
Forskere udvikler billige, høj strømtæthed vanadium flow batteri stakNy generation af vanadiumflow-batteristabelteknologi tilbyder lave omkostninger og høj effekttæthed. Kredit:SHI Dingqin Udviklingen af vedvarende energikilder såsom vind- og solenergi er begræns -
 Åbner den sorte boks af heterogen katalyseKredit:Institut for Kemisk Forskning i Catalonien Forskere fra ICIQs López-gruppe præsenterer en ny metode, der giver mulighed for rationelt design af heterogene katalysatorer. Efter anvendelse af
Åbner den sorte boks af heterogen katalyseKredit:Institut for Kemisk Forskning i Catalonien Forskere fra ICIQs López-gruppe præsenterer en ny metode, der giver mulighed for rationelt design af heterogene katalysatorer. Efter anvendelse af -
 Gennembrud i sur vandelektrolyse via rutheniumbaserede katalysatorerIltudviklingsreaktion (OER) og oxygenreduktionsreaktion (ORR) kan betragtes som to trofæer inden for effektiv udnyttelse af brintenergi. Imidlertid, i sur OER, et stort anvendt potentiale var påkrævet
Gennembrud i sur vandelektrolyse via rutheniumbaserede katalysatorerIltudviklingsreaktion (OER) og oxygenreduktionsreaktion (ORR) kan betragtes som to trofæer inden for effektiv udnyttelse af brintenergi. Imidlertid, i sur OER, et stort anvendt potentiale var påkrævet
- Hvordan er elektroner distribueret i et atomerskall?
- At forme fremtiden for energilagring med ledende ler
- Lys til at bryde båndbreddeloftet
- Tre måder, hvorpå fossilindustrien svigtede kvinder, og hvordan ren energi kan lære af sine fejl
- Urskov risikerer at udløse nyt sammenstød mellem EU og Polen
- Prototype nanonåle genererer nye blodkar i mus


