Hvorfor bliver temperaturen konstant ved kogepunktet for væske?
Her er en sammenbrud:
1. Energiindgang: Når du opvarmer en væske, tilføjer du energi til dens molekyler. Denne energi øger deres kinetiske energi, hvilket får dem til at bevæge sig hurtigere og vibrere mere kraftigt.
2. overvinde intermolekylære kræfter: Når temperaturen stiger, får molekylerne nok energi til at overvinde de attraktive kræfter (som hydrogenbinding, dipol-dipol-interaktioner eller London-spredningskræfter), der holder dem sammen i flydende tilstand.
3. faseændring: På kogepunktet har molekylerne nok energi til at bryde fri fra deres flydende naboer og flygte ud i dampfasen. Denne faseændring kræver en betydelig mængde energi, kaldet fordampningsvarme .
4. Konstant temperatur: Den energi, du fortsætter med at indtaste, bruges til at bryde flere bindinger og fordampes flere molekyler i stedet for at øge den kinetiske energi i de resterende flydende molekyler. Derfor forbliver temperaturen konstant, indtil al væsken er omdannet til damp.
I det væsentlige forbruges den energi, der leveres ved kogepunktet, helt i processen med at overvinde intermolekylære kræfter og ændre stoftilstand, snarere end at øge temperaturen. Dette er grunden til, at temperaturen forbliver konstant under kogning, selvom der stadig tilsættes varme til systemet.
Sidste artikelHvor mange N -atomer i 2 mol NH4OH?
Næste artikelHvad betyder kollisioner i gas?
 Varme artikler
Varme artikler
-
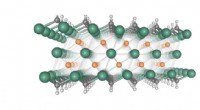 Tager 2D-materialer til MAXMXener er dækket med metal-oxygen og metal-hydroxyl (f.eks. Ti-OH) bindinger, som er kemisk og elektrokemisk aktive. Kredit:KAUST Opdaget af forskere ved Drexel University som elektroder til energ
Tager 2D-materialer til MAXMXener er dækket med metal-oxygen og metal-hydroxyl (f.eks. Ti-OH) bindinger, som er kemisk og elektrokemisk aktive. Kredit:KAUST Opdaget af forskere ved Drexel University som elektroder til energ -
 Raffineret finish til fin fiskeolieProfessor Colin Raston ved Flinders University. Kredit:Flinders University Ikke alle fiskeolier er olier af høj kvalitet, så videnskabsmænd har udviklet en overlegen metode til at hjælpe med at pr
Raffineret finish til fin fiskeolieProfessor Colin Raston ved Flinders University. Kredit:Flinders University Ikke alle fiskeolier er olier af høj kvalitet, så videnskabsmænd har udviklet en overlegen metode til at hjælpe med at pr -
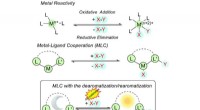 Forståelse af aromaticitet i katalyse for at låse op for nye mulighederFig. 1 Forskellige former for substrataktivering i konventionel og metal-ligand kooperativ katalyse. Kredit: Kemisk kommunikation (2021). DOI:10.1039/D1CC00528F Aromaticitet, et koncept, der norm
Forståelse af aromaticitet i katalyse for at låse op for nye mulighederFig. 1 Forskellige former for substrataktivering i konventionel og metal-ligand kooperativ katalyse. Kredit: Kemisk kommunikation (2021). DOI:10.1039/D1CC00528F Aromaticitet, et koncept, der norm -
 En afhandling bragte nye højpræcisionsmassemålinger for atommasser af isotoper tungere end jernKredit:CC0 Public Domain En stor del af de grundstoffer, der omgiver os, produceres i fusionsreaktioner i stjerner. Imidlertid, grundstoffer tungere end jern kræver mere komplekse processer, der f
En afhandling bragte nye højpræcisionsmassemålinger for atommasser af isotoper tungere end jernKredit:CC0 Public Domain En stor del af de grundstoffer, der omgiver os, produceres i fusionsreaktioner i stjerner. Imidlertid, grundstoffer tungere end jern kræver mere komplekse processer, der f
- Hvad er en balance kemisk ligning til syntese af NABR fra Na og BR2?
- New Delhi skoler lukket på grund af giftig smog
- Styrter rumjunk ned i jorden og andre planeter?
- Sådan finder du alle faktorer ved et tal hurtigt og nemt
- Hvad er Rosetta-stenen, og hvorfor er artefakten vigtig?
- Naturbrandtemperaturer er nøglen til bedre forståelse af luftkvaliteten


