Hvad betyder kollisioner i gas?
Her er en sammenbrud af, hvilke kollisioner i en gas indebærer:
* Natur: Kollisioner mellem gasmolekyler er typisk elastiske , hvilket betyder, at kinetisk energi er konserveret. Dette betyder, at den samlede kinetiske energi af de to kollideringsmolekyler inden kollisionen er lig med den samlede kinetiske energi efter kollisionen.
* frekvens: Hyppigheden af kollisioner afhænger af flere faktorer:
* Temperatur: Højere temperatur betyder hurtigere bevægelige molekyler, hvilket fører til hyppigere kollisioner.
* tryk: Højere tryk betyder flere molekyler pakket i et givet volumen, hvilket resulterer i flere kollisioner.
* molekylær størrelse: Større molekyler har et større tværsnit og er mere tilbøjelige til at kollidere.
* påvirkning: Kollisioner har en betydelig indflydelse på gassens opførsel:
* tryk: Det tryk, der udøves af en gas, er et direkte resultat af disse kollisioner mod beholderens vægge.
* Temperatur: Den gennemsnitlige kinetiske energi af molekylerne er direkte proportional med temperaturen på gassen, som er påvirket af kollisionerne.
* diffusion: Kollisioner letter blandingen af forskellige gasser på grund af den tilfældige bevægelse af molekyler.
Kortfattet: Kollisioner er grundlæggende for forståelsen af gasadfærd og egenskaber. De driver tryk, temperatur og diffusion af gasser.
Sidste artikelHvorfor bliver temperaturen konstant ved kogepunktet for væske?
Næste artikelSlår et matchkemisk eller fysisk?
 Varme artikler
Varme artikler
-
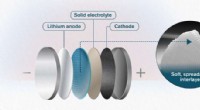 Et smørbart mellemlag kunne gøre solid state-batterier mere stabileSolid state-batterier er af stor interesse for elbilindustrien. Forskere ved Chalmers Tekniske Universitet, Sverige, og Xian Jiaotong University, Kina præsenterer nu en ny måde at bringe dette lovende
Et smørbart mellemlag kunne gøre solid state-batterier mere stabileSolid state-batterier er af stor interesse for elbilindustrien. Forskere ved Chalmers Tekniske Universitet, Sverige, og Xian Jiaotong University, Kina præsenterer nu en ny måde at bringe dette lovende -
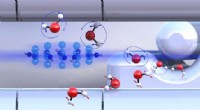 Sammenligning af vandisomerers kemiForsorterede ortho-vand- og para-vand-molekyler med forskelligt orienterede nukleare spins (blå eller røde pile) reagerer med diazenyliumioner (i midten til venstre) ved forskellige hastigheder. Kredi
Sammenligning af vandisomerers kemiForsorterede ortho-vand- og para-vand-molekyler med forskelligt orienterede nukleare spins (blå eller røde pile) reagerer med diazenyliumioner (i midten til venstre) ved forskellige hastigheder. Kredi -
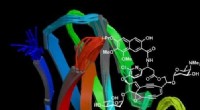 Forskere er verdens første til at reproducere en komplet kopi af anti-tumor-antibiotikumBillede der viser kromoproteinet på Kedarcidin, et komplekst anti-tumor-antibiotikum, som forskerne har reproduceret syntetisk i laboratoriet for første gang. Kredit:Professor Martin Lear, University
Forskere er verdens første til at reproducere en komplet kopi af anti-tumor-antibiotikumBillede der viser kromoproteinet på Kedarcidin, et komplekst anti-tumor-antibiotikum, som forskerne har reproduceret syntetisk i laboratoriet for første gang. Kredit:Professor Martin Lear, University -
 Kemikere identificerer giftige kemikalier i fracking spildevandDr. Emanuela Gionfriddo, adjunkt i analytisk kemi, og Ronald Emmons, UToledo Ph.D. kandidat, undersøger vandkvaliteten og miljøhensyn ved fracking af spildevand for at afgøre, om det er sikkert at gen
Kemikere identificerer giftige kemikalier i fracking spildevandDr. Emanuela Gionfriddo, adjunkt i analytisk kemi, og Ronald Emmons, UToledo Ph.D. kandidat, undersøger vandkvaliteten og miljøhensyn ved fracking af spildevand for at afgøre, om det er sikkert at gen


