Undersøgelse tilbyder en kraftfuld computermodelleringstilgang til cellesimuleringer
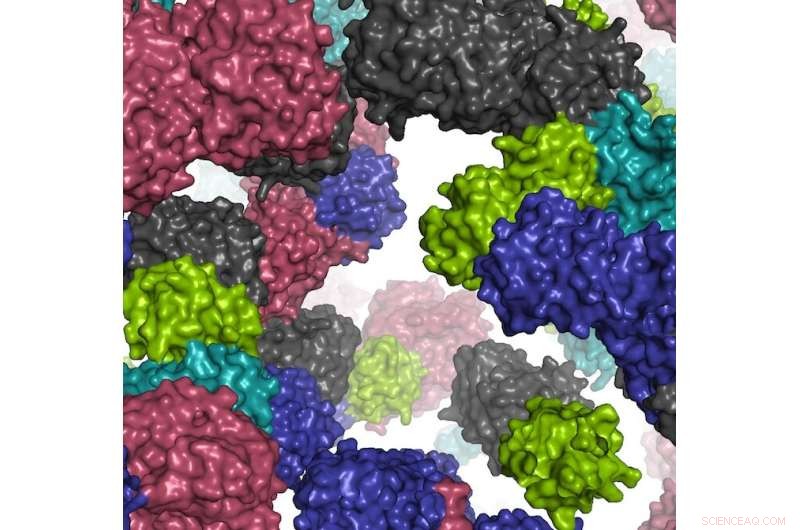
Et fragment af det simulerede cellemiljø. Kredit:Ilya Vakser
En milepælsrapport fra University of Kansas, der vises i denne uge i Proceedings of the National Academy of Sciences foreslår en ny teknik til modellering af molekylært liv med computere.
Ifølge hovedforfatter Ilya Vakser, direktør for Computational Biology Program og Center for Computational Biology og professor i molekylær biovidenskab ved KU, er undersøgelsen af computermodellering af livsprocesser et stort skridt i retning af at skabe en fungerende simulering af en levende celle i atomopløsning . Fremskridtet lover ny indsigt i en celles grundlæggende biologi samt hurtigere og mere præcis behandling af menneskelig sygdom.
"Det er omkring titusinder eller hundredtusindvis af gange hurtigere end de eksisterende atomare opløsningsteknikker," sagde Vakser. "Dette giver hidtil usete muligheder for at karakterisere fysiologiske mekanismer, der nu er langt uden for beregningsmodelleringens rækkevidde, for at få indsigt i cellulære mekanismer og at bruge denne viden til at forbedre vores evne til at behandle sygdomme."
Indtil nu har en stor hindring for at modellere celler via computer været, hvordan man nærmer sig proteiner og deres interaktioner, der ligger i hjertet af cellulære processer. Til dato har etablerede teknikker til modellering af proteininteraktioner afhængt af enten "proteindocking" eller "molekylær simulering."
Ifølge efterforskerne har begge tilgange fordele og ulemper. Mens proteindocking-algoritmer er gode til at prøve rumlige koordinater, tager de ikke højde for "tidskoordinaten" eller dynamikken i proteininteraktioner. I modsætning hertil modellerer molekylære simuleringer dynamikken godt, men disse simuleringer er for langsomme eller for lav opløsning.
"Vores proof-of-concept undersøgelse slår bro mellem de to modelleringsmetoder og udvikler en tilgang, der kan nå hidtil usete simuleringstidsskalaer ved en opløsning af alle atomer," skrev forfatterne.
Vaksers samarbejdspartnere på papiret var Sergei Grudinin fra universitetet i Grenoble Alpes i Frankrig; Eric Deeds fra University of California-Los Angeles; KU-ph.d.-studerende Nathan Jenkins og Petras Kundrotas, assisterende forskningsprofessor med KU's Computational Biology Program.
Efter at have konceptualiseret, hvordan man bedst kombinerer fordelene ved de to proteinmodelleringstilgange, udviklede og kodede teamet en algoritme til at drive den nye simulering.
"Den sværeste udfordring var at udvikle den algoritme, der tilstrækkeligt afspejler den simple grundidé i tilgangen," sagde Vakser.
Men når de først fik det gennembrud, kunne de gå i gang med at validere den nye procedure.
"Paradigmet var let - et strejf af klarhed," sagde Vakser.
"De eksisterende simuleringstilgange bruger det meste af computertiden på at rejse i områder med lav sandsynlighed eller høj energi i systemet. Vi ved alle, hvor disse områder er. I stedet var ideen kun at prøve eller rejse i de høje områder. -sandsynlighed, lavenergiområder og at springe de lavsandsynlige over ved at estimere overgangshastighederne mellem højsandsynlighedstilstandene. Paradigmet er lige så gammelt som selve den biomolekylære modellering og har været meget brugt siden modelleringstidens begyndelse årtier siden."
Men Vakser sagde indtil hans teams nye papir, tilgangen var ikke blevet anvendt på kinetikken af proteininteraktioner i cellulært miljø, fokus for deres undersøgelse.
"Fordi der er langt færre tilstande med høj sandsynlighed end dem med lav sandsynlighed, gav det os en enorm gevinst i beregningshastigheden - titusinder til hundredtusindvis af gange," sagde Vakser. "Dette blev gjort uden tilsyneladende tab af nøjagtighed. Man kan argumentere for, at nøjagtigheden blev opnået, fordi simuleringsprotokollen er baseret på 'docking'-teknikker, som er specifikt designet til at karakterisere proteinsamlinger."
KU-forskeren sagde, at hans cellesimuleringsmetode kunne anvendes til at forske i menneskers sundhed og behandle sygdomme med et nyt niveau af præcision.
"Tilgangen kan bruges til at studere molekylære veje, der ligger til grund for sygdomsmekanismer," sagde Vakser. "Det kan bruges til at bestemme skadelige virkninger af genetiske mutationer ved de ændrede mønstre af proteinforeninger - genetiske mutationer forårsager ændringer i proteinernes struktur, som igen påvirker proteinernes association. Eller det kan bruges til at identificere mål for lægemiddeldesign ved at påvisning af kritiske elementer i proteinassocieringsmønstre."
Ifølge Vakser tilbyder den nye simuleringsteknik mange lovende forskningsmuligheder at udforske fremover.
"Blandt dem er at tilpasse tilgangen til proteininteraktioner med nukleinsyrer, RNA og DNA," sagde han. "Vi vil også gerne tage højde for fleksibiliteten af molekylære former, korrelere med det hurtigt udviklende spektrum af eksperimentelle undersøgelser af det cellulære miljø og anvende proceduren på en model af en faktisk celle - med dens faktiske molekylære komponenter pakket sammen." + Udforsk yderligere
Videnskab på spidsen for 'transformationel' forståelse af livet via cellemodellering, siger forskere
 Varme artikler
Varme artikler
-
 Mente de at gøre det? Uheld og forsæt i en blækspruttehaveEn dyster blæksprutte sad over en seng af kasserede muslingeskaller. Kredit:Peter Godfrey-Smith, Forfatter angivet Vi har for nylig offentliggjort en videnskabelig rapport om blæksprutter, der lev
Mente de at gøre det? Uheld og forsæt i en blækspruttehaveEn dyster blæksprutte sad over en seng af kasserede muslingeskaller. Kredit:Peter Godfrey-Smith, Forfatter angivet Vi har for nylig offentliggjort en videnskabelig rapport om blæksprutter, der lev -
 Hvornår slutter livet på Jorden?Bliver livet en fortid? Donald Nausbaum/Photographers Choice/Getty Images Der var en tid, hvor vores planet var blottet for liv. Intet svømmede gennem dets grumsede, blågrønne hav. Intet voksede på d
Hvornår slutter livet på Jorden?Bliver livet en fortid? Donald Nausbaum/Photographers Choice/Getty Images Der var en tid, hvor vores planet var blottet for liv. Intet svømmede gennem dets grumsede, blågrønne hav. Intet voksede på d -
 Ny software kan bekræfte en persons identitet ved deres DNA på få minutterFor at demonstrere teknologiens bærbarhed, forskere pakket MinION og alle nødvendige celleforberedelsesmaterialer ned i en håndtaske. Kredit:Sophie Zaaijer I science fiction-filmen Gattaca, besøge
Ny software kan bekræfte en persons identitet ved deres DNA på få minutterFor at demonstrere teknologiens bærbarhed, forskere pakket MinION og alle nødvendige celleforberedelsesmaterialer ned i en håndtaske. Kredit:Sophie Zaaijer I science fiction-filmen Gattaca, besøge -
 Offentligheden frygter hajer mindre, når de forstår deres adfærdKredit:University of Sydney Forskere undersøgte mere end 500 besøgende til et akvariums hajtunnel for at forstå, hvordan holdninger til hajer og regeringens hajpolitikker kan ændre sig. Et eksper
Offentligheden frygter hajer mindre, når de forstår deres adfærdKredit:University of Sydney Forskere undersøgte mere end 500 besøgende til et akvariums hajtunnel for at forstå, hvordan holdninger til hajer og regeringens hajpolitikker kan ændre sig. Et eksper
- Hvad er SMC Plastic?
- Udvidelse af omfanget af forudsigelse af farligt vejr
- Hvordan blockchain kunne forhindre fremtidige databrud
- Et mikrotermometer til registrering af små temperaturændringer
- NASA afskiber Orbital ATK lancerer rumstationsforsyninger
- Menneskelige aktiviteter har allerede sat gang i global jorderosion 4, 000 år siden


