Carbon -tetrachlorid CCL4 er ikke -polær, hvilke kræfter holder molekylerne sammen?
Hvorfor CCL4 er ikke -polær:
* symmetri: Molekylet har en tetrahedral form med carbonatomet i midten og fire kloratomer i hjørnerne. Dette symmetriske arrangement betyder, at de individuelle dipolmomenter i C-CL-bindingerne annullerer hinanden.
* Elektronegativitet: Mens klor er mere elektronegativ end kulstof, forhindrer den symmetriske struktur dannelsen af et netto dipolmoment.
Intermolekylære kræfter i CCL4:
Da CCL4 er ikke -polær, er de primære kræfter, der holder molekylerne sammen, London Dispersion Forces (LDFS) . Disse kræfter er svage, midlertidige attraktioner, der opstår som følge af midlertidige udsving i elektronfordeling omkring molekylerne.
Forklaring af LDF'er:
* Midlertidige dipoler: Selvom CCL4 i gennemsnit ikke er polært, kan elektronskyen omkring et molekyle være lidt forskudt, hvilket skaber en midlertidig, øjeblikkelig dipol.
* inducerede dipoler: Disse midlertidige dipoler kan derefter inducere modsatte dipoler i nærliggende molekyler.
* svage attraktioner: Attraktionerne mellem disse midlertidige dipoler er relativt svage, men bidrager stadig til de samlede intermolekylære kræfter.
Nøglepunkter:
* LDF'er er den svageste type intermolekylær kraft.
* LDF -styrke øges med stigende molekylær størrelse og overfladeareal.
* CCL4 har relativt stærke LDF'er på grund af dens store størrelse og polariserbarhed.
Andre kræfter (ubetydelig i CCL4):
* dipol-dipol-kræfter: Disse kræfter forekommer kun i polære molekyler med permanente dipoler.
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, der involverer hydrogen bundet til et stærkt elektronegativt atom (som ilt, nitrogen eller fluor).
Fortæl mig, hvis du har andre spørgsmål!
Sidste artikelUorganinsyrer i kroppen inkluderer?
Næste artikelHvilke ting korroderer metal?
 Varme artikler
Varme artikler
-
 Ny proces booster lignin bio-olie som næste generations brændstofTræer er en kilde til cellulose, hemicelluloser, og lignin. En ny proces til at opgradere lignin bio-olie til kulbrinter kan hjælpe med at udvide brugen af lignin, som nu stort set er et affaldsprod
Ny proces booster lignin bio-olie som næste generations brændstofTræer er en kilde til cellulose, hemicelluloser, og lignin. En ny proces til at opgradere lignin bio-olie til kulbrinter kan hjælpe med at udvide brugen af lignin, som nu stort set er et affaldsprod -
 Computermodel til design af proteinsekvenser, der er optimeret til at binde til lægemiddelmålVed at bruge en computermodelleringstilgang, som de udviklede, MIT-biologer identificerede tre forskellige proteiner, der kan binde selektivt til hver af tre lignende mål, alle medlemmer af Bcl-2-fami
Computermodel til design af proteinsekvenser, der er optimeret til at binde til lægemiddelmålVed at bruge en computermodelleringstilgang, som de udviklede, MIT-biologer identificerede tre forskellige proteiner, der kan binde selektivt til hver af tre lignende mål, alle medlemmer af Bcl-2-fami -
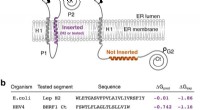 Forskning viser rollen af intra-mebrane interaktioner i viral kontrol af celledødFig. 1:Insertion af vBcl2 Ct hydrofobe sekvenser i eukaryote membraner. Fra:Viralt Bcl2s ’transmembrane domæne interagerer med vært Bcl2 proteiner for at kontrollere cellulær apoptose En forskergr
Forskning viser rollen af intra-mebrane interaktioner i viral kontrol af celledødFig. 1:Insertion af vBcl2 Ct hydrofobe sekvenser i eukaryote membraner. Fra:Viralt Bcl2s ’transmembrane domæne interagerer med vært Bcl2 proteiner for at kontrollere cellulær apoptose En forskergr -
 Autonomt voksende syntetiske DNA-strengePrimer Exchange Reaction (PER) kaskader muliggør autonom vækst af enkeltstrengede DNAer. På toppen, en katalytisk PER-hårnål binder en første primer (vist som en kort grå streng), udløser dens forlæng
Autonomt voksende syntetiske DNA-strengePrimer Exchange Reaction (PER) kaskader muliggør autonom vækst af enkeltstrengede DNAer. På toppen, en katalytisk PER-hårnål binder en første primer (vist som en kort grå streng), udløser dens forlæng


