Er det sandt, at sænkning af temperaturen bremser de fleste kemiske reaktioner ned?
* kinetisk energi og kollisioner: Kemiske reaktioner sker, når molekyler kolliderer med nok energi til at bryde eksisterende bindinger og danne nye. Sænkning af temperaturen reducerer den gennemsnitlige kinetiske energi af molekyler. Dette betyder, at de bevæger sig langsommere og kolliderer sjældnere med mindre kraft.
* Aktiveringsenergi: Hver reaktion har en aktiveringsenergi, som er den minimale energi, der kræves for at reaktionen kan forekomme. Lavere temperaturer betyder, at færre molekyler har nok energi til at overvinde denne barriere.
Undtagelser:
Mens de fleste reaktioner bremser med lavere temperaturer, er der nogle undtagelser:
* eksotermiske reaktioner: Nogle reaktioner frigiver varme (eksotermisk). I disse tilfælde kan sænkning af temperaturen faktisk * fremskynde * reaktionen, fordi den giver den varme, der er nødvendig for at overvinde aktiveringsenergien.
* ligevægtsreaktioner: For reversible reaktioner kan sænkning af temperaturen skifte ligevægt mod den side, der frigiver varme (den eksotermiske side). Dette kan få det til at * vises *, at reaktionen fremskynder, selvom hastighedskonstanten faktisk er faldet.
generelt:
Sænkning af temperaturen bremser generelt kemiske reaktioner. Dette skyldes faldet i kinetisk energi og det reducerede antal molekyler med nok energi til at overvinde aktiveringsenergibarrieren. Der er dog nogle undtagelser, især med eksoterme reaktioner og ligevægtsreaktioner.
Sidste artikelHvad nedbryder mad ved kemiske reaktioner?
Næste artikelHvilken reaktion er ligevægtskonstanten?
 Varme artikler
Varme artikler
-
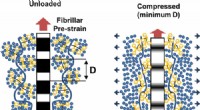 Kollagen i bruskvæv opfører sig som flydende krystaller på en smartphone-skærmKredit:ACS Brusk i vores led indeholder kollagen, som opfører sig lidt som de flydende krystaller på en smartphones skærm, ifølge forskere ved Queen Mary University of London (QMUL). Kollagenet æ
Kollagen i bruskvæv opfører sig som flydende krystaller på en smartphone-skærmKredit:ACS Brusk i vores led indeholder kollagen, som opfører sig lidt som de flydende krystaller på en smartphones skærm, ifølge forskere ved Queen Mary University of London (QMUL). Kollagenet æ -
 En måde at reparere tandemalje påSnapshot af reparationseksperimentet på en menneskelig tand. Kredit:Zhejiang University Et team af forskere fra Zhejiang University og Xiamen University har fundet en måde at reparere menneskelig
En måde at reparere tandemalje påSnapshot af reparationseksperimentet på en menneskelig tand. Kredit:Zhejiang University Et team af forskere fra Zhejiang University og Xiamen University har fundet en måde at reparere menneskelig -
 Machine-learning-metoden skaber en indlærelig kemisk grammatik til at bygge syntetiserbare monomere…Kredit:Pixabay/CC0 Public Domain Kemiske ingeniører og materialeforskere leder konstant efter det næste revolutionerende materiale, kemikalier og lægemidler. Fremkomsten af maskinlæringstilgange
Machine-learning-metoden skaber en indlærelig kemisk grammatik til at bygge syntetiserbare monomere…Kredit:Pixabay/CC0 Public Domain Kemiske ingeniører og materialeforskere leder konstant efter det næste revolutionerende materiale, kemikalier og lægemidler. Fremkomsten af maskinlæringstilgange -
 Team udvikler nye måder at skabe og levere medicin til en bred vifte af immunmedicinske neuropatierKredit:Liverpool School of Tropical Medicine Forskere ved LSTM ser på nye måder at skabe og levere medicin til en bred vifte af immunmedicinerede neuropatier, ved at udvikle nye syntetiske version
Team udvikler nye måder at skabe og levere medicin til en bred vifte af immunmedicinske neuropatierKredit:Liverpool School of Tropical Medicine Forskere ved LSTM ser på nye måder at skabe og levere medicin til en bred vifte af immunmedicinerede neuropatier, ved at udvikle nye syntetiske version
- Internettet:Arbejder hårdt eller næsten ikke arbejde?
- Hvilke stater har kul- og olieaflejringer?
- Forskere bruger S-matrix bootstrap til at undersøge, om strengteori er den eneste konsistente teori…
- Fake news-vaccine:Onlinespil kan inokulere ved at simulere propagandataktikker
- Kosmisk teoretiker og planetjægere deler fysikprisen, når nobels belønner overjordiske opdagelser
- Forskere skitserer metode til DNA -beregning i ny bog


