Hvilken type elementer bliver anioner?
* Elektronegativitet: Ikke -metaller har højere elektronegativitet end metaller. Dette betyder, at de har en stærkere attraktion for elektroner.
* Elektronkonfiguration: Ikke -metaller har en tendens til at have næsten fulde ydre elektronskaller. At få et par elektroner giver dem mulighed for at opnå en stabil, ædelgaskonfiguration.
* Dannelse af anioner: Når ikke -metaller får elektroner, får de en negativ ladning og bliver anioner.
Eksempler på anioner:
* ilt (o²⁻)
* klor (cl⁻)
* svovl (s²⁻)
* nitrogen (n³⁻)
Undtagelser:
Mens de fleste ikke -metaller danner anioner, er der nogle undtagelser, såsom elementerne i gruppe 14 (carbon, silicium, germanium, tin, bly). Disse elementer kan enten vinde eller miste elektroner afhængigt af den specifikke forbindelse.
Vigtig note: Der er nogle metaller, der også kan danne anioner, men dette er mindre almindeligt.
Sidste artikelKemien for akvatiske økosystemer bestemmes min hvad?
Næste artikelHvilket job gør Chemical Tracer?
 Varme artikler
Varme artikler
-
 Generering af strøm fra forurenet luftDen nye enhed må kun udsættes for lys for at rense luft og generere strøm. Kredit:UAntwerpen og KU Leuven Forskere fra University of Antwerpen og KU Leuven (University of Leuven), Belgien, har udv
Generering af strøm fra forurenet luftDen nye enhed må kun udsættes for lys for at rense luft og generere strøm. Kredit:UAntwerpen og KU Leuven Forskere fra University of Antwerpen og KU Leuven (University of Leuven), Belgien, har udv -
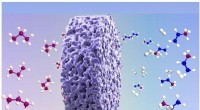 Centimeter-skala porøse enkeltkrystallinske monolitter med Lewis-syresider med høj densitet for at…Centimeterskala mesoporøse enkeltkrystaller monolitter med høj-densitet Lewis-syre-steder på snoet overflade og klart aktive steder leverer forbedret propan-dehydrogenering ved reduceret temperatur. K
Centimeter-skala porøse enkeltkrystallinske monolitter med Lewis-syresider med høj densitet for at…Centimeterskala mesoporøse enkeltkrystaller monolitter med høj-densitet Lewis-syre-steder på snoet overflade og klart aktive steder leverer forbedret propan-dehydrogenering ved reduceret temperatur. K -
 Forskere rapporterer kraftig ionoverførsel i ladet vdW-klynge for første gangSammenfaldskortet viser tidspunktet for flyvninger mellem det første og det andet fragmention, der ankommer til detektoren. Kredit:IMP Siden opdagelsen af den dobbelte helixform af DNA og hypote
Forskere rapporterer kraftig ionoverførsel i ladet vdW-klynge for første gangSammenfaldskortet viser tidspunktet for flyvninger mellem det første og det andet fragmention, der ankommer til detektoren. Kredit:IMP Siden opdagelsen af den dobbelte helixform af DNA og hypote -
 ARS bomuldsforskud hjælper med at starte sårforbindingTACgauze er en ny ikke -vævet bomuldsgas fra ARS og samarbejdspartnere, der hjælper med at standse blødninger og fremme sårheling. Kredit:H&H En ny, ikke -vævet bomuldsbind, der hurtigt standser b
ARS bomuldsforskud hjælper med at starte sårforbindingTACgauze er en ny ikke -vævet bomuldsgas fra ARS og samarbejdspartnere, der hjælper med at standse blødninger og fremme sårheling. Kredit:H&H En ny, ikke -vævet bomuldsbind, der hurtigt standser b
- Billede:Elf på ISS
- Hvad eksemplet med slibende rengøringsmidler?
- 6,57 cm svarer til hvor mange millimeter?
- 'Plasmoniske nanoantenner' viser løfte inden for optiske innovationer
- Deltidsarbejdende mødre med fleksible tidsplaner ender med at arbejde mere uden løn
- For selen i floder, timing betyder noget


