Hvad er den mest almindelige farve på forbindelser Mn2?
Mn²⁺ ioner i vandig opløsning er imidlertid typisk lyserosa **. Denne farve skyldes de elektroniske overgange inden for mn²⁺ionen.
Her er hvorfor:
* Elektronisk konfiguration: Mn²⁺ har den elektroniske konfiguration [AR] 3d⁵.
* D-D-overgange: Når lys interagerer med d orbitaler af Mn²⁺, kan elektroner absorbere energi og flytte til højere energiniveau (D-D-overgange). De specifikke bølgelængder af absorberet afhænger af energiforskellen mellem d orbitaler.
* Farveopfattelse: Mn²⁺ absorberer lys i den grøngul region i det synlige spektrum, hvilket får os til at se den komplementære farve, som er pale pink .
Vigtig note: Den faktiske farve på Mn²⁺ kan variere lidt afhængigt af faktorer som koncentrationen af opløsningen, tilstedeværelsen af andre ioner og pH.
Sidste artikelEr skinnende en kemisk egenskab ved jern?
Næste artikelHvad er farven på mangan -sulfat, og hvad dets opløselighed?
 Varme artikler
Varme artikler
-
 En hurtig, effektiv COVID-19-biosensor er under udviklingRajesh Sardar, center, taler med Omolade Olofintuyi, venstre, en bachelor fra Howard University, som forskede i en avanceret biosensor for COVID-19 i sit laboratorium denne sommer gennem et NSF-finans
En hurtig, effektiv COVID-19-biosensor er under udviklingRajesh Sardar, center, taler med Omolade Olofintuyi, venstre, en bachelor fra Howard University, som forskede i en avanceret biosensor for COVID-19 i sit laboratorium denne sommer gennem et NSF-finans -
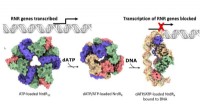 Ny mekanisme til regulering af forsyningen af DNA-byggesten til bedre antibiotikaVirkningsmekanismen af den RNR-specifikke repressor NrdR. Overfladerepræsentation af cryo-EM-kortene for de dodecameriske, oktamere og DNA-bundne tetramere NrdR-strukturer. NrdR-monomerer i hver tet
Ny mekanisme til regulering af forsyningen af DNA-byggesten til bedre antibiotikaVirkningsmekanismen af den RNR-specifikke repressor NrdR. Overfladerepræsentation af cryo-EM-kortene for de dodecameriske, oktamere og DNA-bundne tetramere NrdR-strukturer. NrdR-monomerer i hver tet -
 Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir
Beskadigede planter og falske parfumer kan identificeres hurtigt og pålideligt i realtidHarpiksen, der udskilles af et beskadiget nåletræ for at beskytte skadestedet, har sin egen karakteristiske chirale signatur inden for anlæggets samlede emissioner. Kredit:Lykourgos Bougas Den chir -
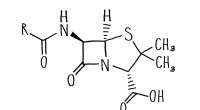 Den rettede evolution åbner døren til nye antibiotikaEn beta-lactam ring er kernen i mange antibiotika, inklusive penicillin. Kredit:Caltech I det igangværende våbenkapløb med mennesker og deres antibiotika på den ene side, og bakterier med deres ev
Den rettede evolution åbner døren til nye antibiotikaEn beta-lactam ring er kernen i mange antibiotika, inklusive penicillin. Kredit:Caltech I det igangværende våbenkapløb med mennesker og deres antibiotika på den ene side, og bakterier med deres ev
- Hvad er semi -essentielle aminosyrer?
- Astronomer opdager en meget varm Jupiter -eksoplanet, der kredser om en lys, varm stjerne
- Hvorfor at deltage i en klimastrejke kan ændre mening (vigtigst din egen)
- NASA samarbejder med industrien om nye rumvandrings- og månevandringstjenester
- Hvad påvirker en genstands evne til at flyde på en væske?
- Hvilke solfunktioner kan øge vinden?


