Ved en konstant temperatur falder trykket, der udøves af en mol gas, hvis den tilgængelige volumen øges?
Her er hvorfor:
* Tryk og volumen er omvendt proportional: Boyle's lov siger, at trykket fra en gas ved en konstant temperatur er omvendt proportionalt med dens volumen. Dette betyder, at hvis du øger volumenet af en gas, vil trykket falde proportionalt, og omvendt.
* molekylære kollisioner: Tryk i en gas er forårsaget af kollisioner af gasmolekyler med væggene i deres beholder. Når du øger volumenet, har molekylerne mere plads til at bevæge sig rundt. Dette betyder, at de kolliderer med væggene sjældnere, hvilket resulterer i lavere tryk.
Matematisk repræsentation:
Boyle's lov udtrykkes matematisk som:
P₁v₁ =p₂v₂
hvor:
* P₁ er det oprindelige pres
* V₁ er det oprindelige bind
* P₂ er det endelige pres
* V₂ er det endelige bind
Eksempel:
Hvis du fordobler volumenet af en gas, mens du holder temperaturen konstant, falder trykket med halvdelen.
Sidste artikelHvorfor ville Biurets -opløsning blive gul?
Næste artikelHvilket kemikalie kan bruges til at få jern til at smelte?
 Varme artikler
Varme artikler
-
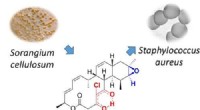 Antimikrobielt naturprodukt, der er aktivt mod både MRSA og malariaforårsagende parasitAnaloger af det naturlige produkt chlorotonil blev opnået ved semisyntese gennem regio- og stereoselektiv epoxidation og efterfølgende ringåbning. Derivaterne bibeholdt aktivitet mod multiresistente g
Antimikrobielt naturprodukt, der er aktivt mod både MRSA og malariaforårsagende parasitAnaloger af det naturlige produkt chlorotonil blev opnået ved semisyntese gennem regio- og stereoselektiv epoxidation og efterfølgende ringåbning. Derivaterne bibeholdt aktivitet mod multiresistente g -
 Forskere kæmper mod udryddelse for at afsløre træers kræftbekæmpende egenskaberEt kinesisk frimærke til ære for det kritisk truede træ blev udstedt i 1992. Kredit:Designet af Zeng Xiaolian Tre kinesiske grantræer på et naturreservat i det sydøstlige Kina er de sidste af dere
Forskere kæmper mod udryddelse for at afsløre træers kræftbekæmpende egenskaberEt kinesisk frimærke til ære for det kritisk truede træ blev udstedt i 1992. Kredit:Designet af Zeng Xiaolian Tre kinesiske grantræer på et naturreservat i det sydøstlige Kina er de sidste af dere -
 Maskinlæringssystem fremskynder opdagelsen af nye materialer til 3D-printKredit:Pixabay/CC0 Public Domain Den voksende popularitet af 3D-print til fremstilling af alle slags genstande, fra tilpasset medicinsk udstyr til billige hjem, har skabt mere efterspørgsel efter
Maskinlæringssystem fremskynder opdagelsen af nye materialer til 3D-printKredit:Pixabay/CC0 Public Domain Den voksende popularitet af 3D-print til fremstilling af alle slags genstande, fra tilpasset medicinsk udstyr til billige hjem, har skabt mere efterspørgsel efter -
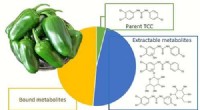 Peberplante suger antibiotika til personlig plejeproduktKredit:American Chemical Society Det kan nogle gange være svært at finde tandpasta, sæber og andre toiletartikler uden antibiotika. Deres popularitet har forårsaget en stigning i miljøniveauer af
Peberplante suger antibiotika til personlig plejeproduktKredit:American Chemical Society Det kan nogle gange være svært at finde tandpasta, sæber og andre toiletartikler uden antibiotika. Deres popularitet har forårsaget en stigning i miljøniveauer af
- Hvorfor udgør de fleste atomer kemiske bindinger?
- Otto Fritz Meyerhof
- Indeholder en blanding forskellige stoffer, der ikke er kemisk kombineret med hinanden?
- Stjernen, der overlevede en supernova
- Transformativ 3-D print tilgang etableret ud fra indsigt i udviklingsbiologi
- Hvad er det bløde lag af sten i jordens kappe?


