Hvad er den molære opløselighed af PBBR2 i vand?
1. Forstå ligevægten
Blybromid (PBBR₂) er en sparsomt opløselig ionisk forbindelse. Når det opløses i vand, etablerer det en ligevægt:
`` `
PBBR₂ (s) ⇌ Pb²⁺ (aq) + 2Br⁻ (aq)
`` `
2. Opret opløselighedsproduktet (KSP) -udtrykket
Opløselighedsproduktkonstanten (KSP) for PBBR₂ er produktet af ionkoncentrationerne i ligevægt, hævet til deres støkiometriske koefficienter:
`` `
Ksp =[pb²⁺] [br⁻] ²
`` `
3. Definer molær opløselighed
Molær opløselighed (er) er koncentrationen af metalkationen (PB²⁺ i dette tilfælde), der opløses i en mættet opløsning. Da forholdet mellem Pb²⁺ og BR⁻ er 1:2, er bromidkoncentrationen ved ligevægt 2s.
4. Erstat i KSP -ekspressionen
Udskift de molære opløselighedsudtryk i KSP -ligningen:
`` `
KSP =(S) (2S) ² =4S³
`` `
5. Slå op KSP -værdien
KSP for PBBR₂ er 6,6 x 10⁻⁶ ved 25 ° C.
6. Løs for molær opløselighed (er)
Nu kan du løse for den molære opløselighed (er):
`` `
6,6 x 10⁻⁶ =4s³
s³ =1,65 x 10⁻⁶
s =∛ (1,65 x 10⁻⁶)
s ≈ 1,18 x 10 ² m
`` `
Derfor er den molære opløselighed af PBBR₂ i vand ca. 1,18 x 10⁻² m.
 Varme artikler
Varme artikler
-
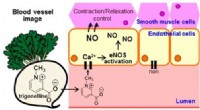 Forbindelser i monsterræddike kunne hjælpe med at tæmme hjerte-kar-sygdommeKredit:American Chemical Society Træd gulerødder til side, løg og broccoli. Den nyeste hjertesunde grøntsag kunne være en gigantisk, rekordsættende radise. I en undersøgelse, der vises i ACS Tids
Forbindelser i monsterræddike kunne hjælpe med at tæmme hjerte-kar-sygdommeKredit:American Chemical Society Træd gulerødder til side, løg og broccoli. Den nyeste hjertesunde grøntsag kunne være en gigantisk, rekordsættende radise. I en undersøgelse, der vises i ACS Tids -
 Undersøgelse foreslår vej til forbedring af genopladelige lithium-batterierNy forskning tyder på, at opnåelse af glattere overflader på en fast elektrolyt kan eliminere eller i høj grad reducere problemet med dendritdannelse. De fleste af nutidens lithium-ion-batterier,
Undersøgelse foreslår vej til forbedring af genopladelige lithium-batterierNy forskning tyder på, at opnåelse af glattere overflader på en fast elektrolyt kan eliminere eller i høj grad reducere problemet med dendritdannelse. De fleste af nutidens lithium-ion-batterier, -
 Forskning finder et godt sted til at udvikle bedre cellulosenedbrydende enzymerPostdoc-forsker Antonella Amore og senioringeniør Brandon Knott arbejder på prøver i laboratoriet. Den nye forskning om forholdet mellem små sukkerarter (glykaner), deres funktion, og deres placering
Forskning finder et godt sted til at udvikle bedre cellulosenedbrydende enzymerPostdoc-forsker Antonella Amore og senioringeniør Brandon Knott arbejder på prøver i laboratoriet. Den nye forskning om forholdet mellem små sukkerarter (glykaner), deres funktion, og deres placering -
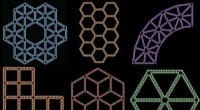 Computerprogram kan oversætte en 2-D-tegning i fri form til en DNA-strukturForskere fra MIT og Arizona State University har skabt et computerprogram, der kan oversætte tegninger af vilkårlige former til todimensionelle strukturer lavet af DNA. Kredit:Hyungmin Jun Forsker
Computerprogram kan oversætte en 2-D-tegning i fri form til en DNA-strukturForskere fra MIT og Arizona State University har skabt et computerprogram, der kan oversætte tegninger af vilkårlige former til todimensionelle strukturer lavet af DNA. Kredit:Hyungmin Jun Forsker
- Forskning ser på materialets friktionsegenskaber
- Ingen, metaloxid-nanopartikler i din mad dræber dig ikke
- Hvad er HDPE-plast?
- Hvordan fungerer GPS på en LG800G -mobiltelefon?
- En graf, der viser forholdet mellem stjerner absolut størrelse og temperatur, er hvad?
- Hvad kontrollerer aktiviteten af melanocytter?


