Hvilken familie indeholder en fuld oktet af valenselektroner?
Her er hvorfor:
* Valenselektroner: Dette er elektronerne i det yderste energiniveau af et atom, der er involveret i kemisk binding.
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration med otte elektroner i deres yderste skal (som de ædle gasser).
* ædle gasser: Disse elementer har en fuld ydre skal af elektroner, hvilket gør dem meget ureaktive. De har allerede den stabile konfiguration, de ønsker.
Eksempler på ædelgasser: Helium (He), Neon (NE), Argon (AR), Krypton (KR), Xenon (XE) og Radon (RN).
Sidste artikelHvilke stoffer er flydende ved stuetemperatur?
Næste artikelNavn på binding mellem glukosemolekyler for at danne en polymer?
 Varme artikler
Varme artikler
-
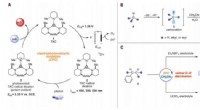 Elektrofotokatalytisk diamination af vicinale C -H -bindingerElektrofotokatalytisk amination af C -H -bindinger. (A) Generisk elektrofotokatalytisk cyklus med trisaminocyclopropenium (TAC) 1. (B) Ritter-type C-H amineringsreaktion. (C) Elektrofotokatalytiske vi
Elektrofotokatalytisk diamination af vicinale C -H -bindingerElektrofotokatalytisk amination af C -H -bindinger. (A) Generisk elektrofotokatalytisk cyklus med trisaminocyclopropenium (TAC) 1. (B) Ritter-type C-H amineringsreaktion. (C) Elektrofotokatalytiske vi -
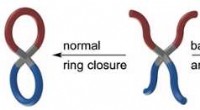 Kemikere syntetiserer molekylære kringlerKredit:HIMS Kemikere ved University of Amsterdams Van t Hoff Institute for Molecular Sciences har opdaget en ny klasse af molekyler. I denne uge melder de ind Naturkommunikation på deres syntese
Kemikere syntetiserer molekylære kringlerKredit:HIMS Kemikere ved University of Amsterdams Van t Hoff Institute for Molecular Sciences har opdaget en ny klasse af molekyler. I denne uge melder de ind Naturkommunikation på deres syntese -
 Mekanistisk grundlag for iltfølsomhed i titaniumMekanisk adfærd af ren Ti, Ti-0,1O, og Ti-0,3O legeringer ved stuetemperatur (RT) (~300 K) og kryogen temperatur (~100 K). (A) Repræsentative tekniske spændings-tøjningskurver for de tre legeringer me
Mekanistisk grundlag for iltfølsomhed i titaniumMekanisk adfærd af ren Ti, Ti-0,1O, og Ti-0,3O legeringer ved stuetemperatur (RT) (~300 K) og kryogen temperatur (~100 K). (A) Repræsentative tekniske spændings-tøjningskurver for de tre legeringer me -
 Forskere rapporterer om effektiv platformsteknologi til fremstilling af cephalosporin-antibiotikaKredit:CC0 Public Domain Antibiotika redder utallige menneskeliv - moderne medicin uden dem er utænkelig. Den største volumenandel af industrielt fremstillede antibiotika i dag er cephalosporiner,
Forskere rapporterer om effektiv platformsteknologi til fremstilling af cephalosporin-antibiotikaKredit:CC0 Public Domain Antibiotika redder utallige menneskeliv - moderne medicin uden dem er utænkelig. Den største volumenandel af industrielt fremstillede antibiotika i dag er cephalosporiner,
- Kemikere foreslår en ny metode til syntese af pyrroler
- Linde sikker på Praxair-fusion efter stærkt 1. kvartal
- Hvilken erklæring viser bedst, hvorfor månen ser ud til at producere lys?
- Fem fremmedfjendske myter om immigranter i Sydafrika afvist af forskere
- Undersøgelse af stigningen i oxygenisk fotosyntese
- Facebook, Twitter-nedtagninger viser dilemma med hensyn til at bremse manipulation


