Opdeler reaktionshastigheden for en given reaktant eller produkt med dets støkiometriske koefficient?
Hvorfor dele med støkiometrisk koefficient?
* Konsekvent sats: Hastigheden for en reaktion defineres som ændringen i koncentration af en reaktant eller et produkt over tid. Hastigheden kan dog variere afhængigt af hvilke arter, du ser på. For eksempel i reaktionen:
2A + B → 3C
Hastigheden for forsvinden af A kan være dobbelt så hurtig som forsvinden af B. For at få et konstant mål for reaktionshastigheden er vi nødt til at redegøre for disse forskelle i støkiometri.
* relative satser: Dividering med den støkiometriske koefficient giver os mulighed for at udtrykke reaktionshastigheden med hensyn til ændringshastigheden for ethvert reaktant eller produkt. Dette giver et mere komplet billede af reaktionens fremskridt.
hvordan det fungerer:
1. støkiometriske koefficienter: Disse tal repræsenterer de relative mængder af hver reaktant og produkt involveret i en afbalanceret kemisk ligning.
2. ændringshastighed: Ændringshastigheden er ændringen i koncentration af en art over tid. Det kan være positivt (for produkter, som de dannes) eller negative (for reaktanter, da de forbruges).
3. Beregning: For at få den konsistente reaktionshastighed deler vi hastigheden for ændring af hver art med dens støkiometriske koefficient.
Eksempel:
Overvej reaktionen:2no₂ (g) → n₂o₄ (g)
* sats for ingen forsvinden: -Δ [no₂]/ΔT
* hastighed på N₂O₄ Dannelse: +Δ [N₂O₄]/ΔT
For at finde reaktionshastigheden kan vi bruge begge arter:
* reaktionshastighed: (-Δ [no₂] / ΔT) / 2 =(+Δ [n₂o₄] / ΔT) / 1
Nøglepunkter:
* Reaktionshastigheden er altid positiv .
* Denne metode gælder for både reaktanter og produkter.
* Det er vigtigt at bruge en afbalanceret kemisk ligning til at bestemme de korrekte støkiometriske koefficienter.
Kortfattet:
Opdeling af ændringshastigheden af en reaktant eller et produkt med dets støkiometriske koefficient giver os mulighed for at udtrykke reaktionshastigheden på en konsistent og meningsfuld måde, uanset hvilke arter der overvåges. Dette er et grundlæggende koncept inden for kemisk kinetik.
 Varme artikler
Varme artikler
-
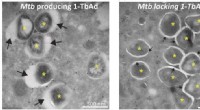 Antacida hjælper tuberkulosebakterier med at overleveElektronmikroskopibilleder, der viser bakterierne (*) der producerer 1-TbAd er omgivet af et hævet fagosom (store pile, venstre billede) og bakterier, der ikke producerer 1-TbAd, er omgivet af stramme
Antacida hjælper tuberkulosebakterier med at overleveElektronmikroskopibilleder, der viser bakterierne (*) der producerer 1-TbAd er omgivet af et hævet fagosom (store pile, venstre billede) og bakterier, der ikke producerer 1-TbAd, er omgivet af stramme -
 Et strejf af guld sender krystaller elektriske af spændingAtomisk model af en Au-SrTiO 3 Schottky interface. Kredit:University of Warwick Et strejf af guld - eller et andet ædelmetal - kan ændre strukturen af en krystal og dens iboende egenskaber, fy
Et strejf af guld sender krystaller elektriske af spændingAtomisk model af en Au-SrTiO 3 Schottky interface. Kredit:University of Warwick Et strejf af guld - eller et andet ædelmetal - kan ændre strukturen af en krystal og dens iboende egenskaber, fy -
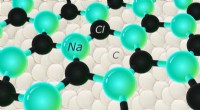 Salt værd:Forskere rapporterer det første tilfælde af sekskantet NaClKredit:Skolkovo Institut for Videnskab og Teknologi Skoltech- og MIPT-forskere har forudsagt og derefter eksperimentelt bekræftet eksistensen af eksotiske sekskantede tynde film af NaCl på en di
Salt værd:Forskere rapporterer det første tilfælde af sekskantet NaClKredit:Skolkovo Institut for Videnskab og Teknologi Skoltech- og MIPT-forskere har forudsagt og derefter eksperimentelt bekræftet eksistensen af eksotiske sekskantede tynde film af NaCl på en di -
 Belysning af nanopartikelvækst med røntgenstrålerBrookhaven Lab-forskere Mingyuan Ge, Iradwikanari Waluyo, og Adrian Hunt er afbildet fra venstre mod højre ved IOS-strålelinjen, hvor de studerede vækstvejen for en effektiv katalysator til brintbrænd
Belysning af nanopartikelvækst med røntgenstrålerBrookhaven Lab-forskere Mingyuan Ge, Iradwikanari Waluyo, og Adrian Hunt er afbildet fra venstre mod højre ved IOS-strålelinjen, hvor de studerede vækstvejen for en effektiv katalysator til brintbrænd


