Hvad gør elektroner, når sølv danner en kemisk binding?
1. Silver's elektroniske konfiguration:
* Sølv (AG) har et atomnummer på 47, hvilket betyder, at det har 47 protoner og 47 elektroner.
* Dens elektroniske konfiguration er [KR] 4D¹⁰ 5S¹. Dette betyder, at dens yderste skal (den 5. skal) kun har en valenselektron.
2. Typer af limning:
* Metallisk binding: Sølv, der er et metal, danner primært metalliske bindinger med andre sølvatomer. Ved metallisk binding delokaliseres valenselektronerne og danner et "hav" af elektroner, der bevæger sig frit gennem hele metalstrukturen. Dette skaber stærke attraktioner mellem de positivt ladede metalioner og det negativt ladede elektronhav, hvilket resulterer i en stærk og stabil binding.
* kovalent binding: Sølv kan også danne kovalente bindinger med ikke -metaller, såsom i sølvhalogenider (AGCL, AGBR, AGI). I kovalent binding deler Silver sin valenselektron med ikke -metalatomet, hvilket skaber et delt elektronpar.
3. Elektrondeltagelse i binding:
* Metallisk binding: I metallisk sølv løsnes den enkelte valenselektron i 5'erne orbital fra sølvatomet og slutter sig til havet af elektroner. Denne delte elektronpool bidrager til den fremragende elektriske og termiske ledningsevne af sølv.
* kovalent binding: Ved kovalent binding opstår den enkelte valenselektron af sølvpar med et elektron fra ikke -metalatomet for at danne et delt elektronpar. Denne deling skaber en stabil kovalent binding.
Kortfattet: Valenselektroner af sølv er afgørende for dannelse af kemiske bindinger. Ved metallisk binding delokaliserer de for at danne et hav af elektroner, mens de i kovalent binding deles med andre atomer. Denne elektronadfærd bidrager til de unikke egenskaber ved sølv, herunder dens ledningsevne, formbarhed og reaktivitet.
Sidste artikelHvad gør en gas og den ikke flydende eller solid?
Næste artikelHvilket organ, der indeholder en stærk syre?
 Varme artikler
Varme artikler
-
 Forskere udvikler molekylær kode for melanin-lignende materialerPolymere pigmenter blev fremstillet ved guidet oxidation af peptidsamlinger. Kredit:Matej Vakula, NYC Forskere har længe vidst, at melanin - de pigmenter, der giver farve til huden, hår og øjne -
Forskere udvikler molekylær kode for melanin-lignende materialerPolymere pigmenter blev fremstillet ved guidet oxidation af peptidsamlinger. Kredit:Matej Vakula, NYC Forskere har længe vidst, at melanin - de pigmenter, der giver farve til huden, hår og øjne - -
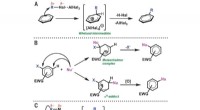 Calciumforbindelsen går i stykker som frastøder som regelSærskilte aromatiske alkyleringsmekanismer. (A) Elektrofil aromatisk substitution:F-C-alkylering af benzen via Wheland-mellemprodukt. (B) Nukleofil aromatisk substitution af elektronfattige arener via
Calciumforbindelsen går i stykker som frastøder som regelSærskilte aromatiske alkyleringsmekanismer. (A) Elektrofil aromatisk substitution:F-C-alkylering af benzen via Wheland-mellemprodukt. (B) Nukleofil aromatisk substitution af elektronfattige arener via -
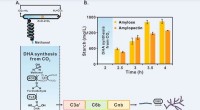 Kinesiske videnskabsmænd rapporterer om stivelsesyntese fra kuldioxidStivelsessyntese via kunstig stivelse anabolsk vej (ASAP) fra kuldioxid. Kredit:TIBCAS Kinesiske videnskabsmænd rapporterede for nylig om en de novo-rute til kunstig stivelsessyntese fra kuldioxid
Kinesiske videnskabsmænd rapporterer om stivelsesyntese fra kuldioxidStivelsessyntese via kunstig stivelse anabolsk vej (ASAP) fra kuldioxid. Kredit:TIBCAS Kinesiske videnskabsmænd rapporterede for nylig om en de novo-rute til kunstig stivelsessyntese fra kuldioxid -
 Et bionisk blad kunne hjælpe med at brødføde verdenRadiserne til højre blev dyrket ved hjælp af et bionisk blad, der producerer gødning med bakterier, sollys, vand og luft. Kredit:Nocera lab, Harvard Universitet I anden halvdel af det 20. århundre
Et bionisk blad kunne hjælpe med at brødføde verdenRadiserne til højre blev dyrket ved hjælp af et bionisk blad, der producerer gødning med bakterier, sollys, vand og luft. Kredit:Nocera lab, Harvard Universitet I anden halvdel af det 20. århundre
- Hvilke planter og dyr i et havøkosystem?
- Hvad er det brændende stof i et stof?
- Frygt har negativ indvirkning på afbødningsadfærd over for klimaændringer
- Fremskynder, hvordan nye lægemidler fremstilles med maskinlæring
- Store oversvømmelser steg i tempererede klimaer, men faldt andre steder
- Hvorfor måne ikke synlig om dagen?


