Ville der ske, hvis ligevægten af en svag syre -dissocieringsreaktion var ked af det?
le Chateliers princip:
Le Chateliers princip siger, at hvis der anvendes en ændring af betingelsen på et system i ligevægt, vil systemet skifte i en retning, der lindrer stresset. Dette gælder også for svage syre -dissocieringsreaktioner.
måder at forstyrre ligevægt:
* Tilføjelse af mere syre: Dette vil øge koncentrationen af den uudskilte syre, hvilket får ligevægten til at skifte til højre , der favoriserer dissociation til at producere flere hydroniumioner (H₃O⁺) og konjugatbasen.
* Tilføjelse af mere konjugatbase: Dette vil øge koncentrationen af den konjugatbase, hvilket får ligevægten til at skifte til venstre , der favoriserer reformationen af den uudskillede syre.
* Tilføjelse af en stærk syre: Dette vil øge koncentrationen af H₃O⁺, hvilket får ligevægten til at skifte til venstre , der favoriserer reformationen af den uudskillede syre. Dette skyldes, at den stærke syre effektivt fjerner den konjugerede base gennem neutralisering.
* Tilføjelse af en stærk base: Dette fjerner H₃O⁺, hvilket får ligevægten til at skifte til højre , der favoriserer dissociation til at erstatte den fjernede H₃O⁺.
* Tilføjelse af en fælles ion: Tilsætning af et salt, der indeholder den konjugatbase af den svage syre, vil øge koncentrationen af denne ion, hvilket får ligevægten til at skifte til venstre , der favoriserer reformationen af den uudskillede syre.
* Ændring af temperaturen: Forøgelse af temperaturen vil favorisere den endotermiske reaktion, som i dette tilfælde er dissociation af den svage syre. At reducere temperaturen vil favorisere den eksotermiske reaktion, som er reformationen af den uudskillede syre.
Konsekvenser af ligevægtsskift:
* pH -ændring: At skifte ligevægt vil ændre koncentrationen af H₃O⁺, der direkte påvirker opløsningens pH.
* Forøget eller nedsat dissociation: Omfanget af dissociation af den svage syre vil ændre sig, hvilket fører til forskellige koncentrationer af den uudskillede syre og dens konjugatbase.
Eksempel:
Overvej dissociation af eddikesyre (ch₃cooh):
Ch₃cooh (aq) + h₂o (l) ⇌ h₃o⁺ (aq) + ch₃coo⁻ (aq)
Tilsætning af natriumacetat (ch₃coona) til denne opløsning ville øge koncentrationen af konjugatbasen (ch₃coo⁻). Dette ville skifte ligevægt til venstre, hvilket reducerer dissociation af eddikesyre og fører til en højere pH (mindre sur) opløsning.
Sammenfattende giver forståelse af Le Chateliers princip dig mulighed for at forudsige, hvordan ligevægten af en svag syre -dissociationsreaktion vil blive påvirket af forskellige ændringer i forhold.
 Varme artikler
Varme artikler
-
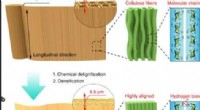 En enkeltcifret-mikrometer tykkelse træhøjttalerSkematisk af top-down tilgangen til direkte at transformere naturlig balsa til ultratynde træfilm. (a) Venstre:skematisk af det naturlige træ med dets porøse struktur. Midten:mikrostrukturen af cell
En enkeltcifret-mikrometer tykkelse træhøjttalerSkematisk af top-down tilgangen til direkte at transformere naturlig balsa til ultratynde træfilm. (a) Venstre:skematisk af det naturlige træ med dets porøse struktur. Midten:mikrostrukturen af cell -
 Forskere låser op for kræftfremkaldende mekanisme af E. coli-toksin med syntetisk biologi tilgangProf. Qian Peiyuan (til højre) og en forsker fra hans team, LI Zhongrui, dyrkning af bakterier med maskinen til højre. Kredit:Hong Kong University of Science and Technology Et tværfagligt team af
Forskere låser op for kræftfremkaldende mekanisme af E. coli-toksin med syntetisk biologi tilgangProf. Qian Peiyuan (til højre) og en forsker fra hans team, LI Zhongrui, dyrkning af bakterier med maskinen til højre. Kredit:Hong Kong University of Science and Technology Et tværfagligt team af -
 Antioxidanter og plast kan fremstilles af biprodukter fra hvedeformalingVandet, indeholdende hemicellulose, køres gennem et filter. Kredit:KTH Kgl. Teknologisk Institut Det bruges normalt som husdyrfoder, men hvedeklids værdi i human ernæring og medicin kan snart nå s
Antioxidanter og plast kan fremstilles af biprodukter fra hvedeformalingVandet, indeholdende hemicellulose, køres gennem et filter. Kredit:KTH Kgl. Teknologisk Institut Det bruges normalt som husdyrfoder, men hvedeklids værdi i human ernæring og medicin kan snart nå s -
 Ny funktionel indsigt i proteinkompleks, muligt nyt mål for antibiotikaProteinkomplekset (rødt) i bakteriens ydre membran. Kredit:Utrecht University Faculty of Science Forskere ved Utrecht Universitet har fået ny indsigt i strukturen og funktionen af et proteinkomp
Ny funktionel indsigt i proteinkompleks, muligt nyt mål for antibiotikaProteinkomplekset (rødt) i bakteriens ydre membran. Kredit:Utrecht University Faculty of Science Forskere ved Utrecht Universitet har fået ny indsigt i strukturen og funktionen af et proteinkomp
- Nyt katodemateriale til højtydende natriumionbatterier kan gavne energilagring i stor skala
- EU's tech -titaners skatteplan raser Washington
- Undersøgelse viser, hvordan meningitis-fremkaldende bakterier kan mærke feber for at undgå immund…
- En anden temperaturenhed kaldet Fahrenheit blev foreslået af?
- Top 10 rumkonspirationsteorier
- Strålingsdetekterende plastik får ingrediens til at forblive i det klare


