Hvilken type binding har svovl hexafluorid?
Her er hvorfor:
* svovl (r) Har 6 valenselektroner og har brug for 2 mere for at opnå en stabil oktet.
* fluor (f) Har 7 valenselektroner og har brug for 1 mere for at opnå en stabil oktet.
I SF 6 , svovl deler et elektron med hvert af de seks fluoratomer. Dette danner seks individuelle kovalente bindinger, hvilket resulterer i et stabilt molekyle, hvor svovl og fluor begge opnår en fuld oktet af elektroner.
Sidste artikelHvad kan være et solidt, når det ikke er køligt og væske ikke?
Næste artikelHvorfor er udvalget af pH -rettet?
 Varme artikler
Varme artikler
-
 Superfleksible elektroluminescerende enheder udvikletUdvikling af superfleksible elektroluminescerende enheder. Kredit:Pusan National University Fremtiden vil blive farvet af bøj-at-vilje lyskilder. En succesfuld forskningsundersøgelse udført af e
Superfleksible elektroluminescerende enheder udvikletUdvikling af superfleksible elektroluminescerende enheder. Kredit:Pusan National University Fremtiden vil blive farvet af bøj-at-vilje lyskilder. En succesfuld forskningsundersøgelse udført af e -
 Gør det nemmere at opfange kuldioxid i cementindustrienCement er et af verdens mest almindelige byggematerialer, og dens fremstilling tegner sig for syv procent af vores drivhusgasudledning. Det er vi nødt til at gøre noget ved. Dette billede er taget i S
Gør det nemmere at opfange kuldioxid i cementindustrienCement er et af verdens mest almindelige byggematerialer, og dens fremstilling tegner sig for syv procent af vores drivhusgasudledning. Det er vi nødt til at gøre noget ved. Dette billede er taget i S -
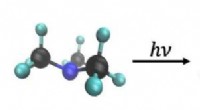 Se molekyler splittes i realtidForskerne viste, at når de exciterer molekylet med en foton, en af dens methylgrupper splittes væk. Kredit:doi:10.1002/anie.201902228 Ved hjælp af en ny røntgenteknik, et team af forskere var i
Se molekyler splittes i realtidForskerne viste, at når de exciterer molekylet med en foton, en af dens methylgrupper splittes væk. Kredit:doi:10.1002/anie.201902228 Ved hjælp af en ny røntgenteknik, et team af forskere var i -
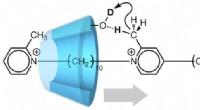 Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist
Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist
- Hvor kommer næsten alle jordens energi i atmosfæren fra?
- Korruption blandt Indiens fabriksinspektører gør arbejdsregulering dyr
- Menisk-assisteret teknik producerer højeffektiv perovskite PV-film
- Ny forskning viser en iøjnefaldende mangel på gennemsigtighed i miljøorganisationer
- Ny 3D-printet sensor kan registrere glyphosat i drikkevarer
- En rumsonde har returneret prøver til jorden af krystaller fundet på en fjern planet. Ved at stu…


