Hvorfor har en molekylære krystaller et lavt smeltepunkt?
* svage intermolekylære kræfter: Molekylerne i en molekylær krystal holdes sammen af relativt svage intermolekylære kræfter (IMF), såsom van der Waals-kræfter, brintbindinger eller dipol-dipolinteraktioner. Disse kræfter er meget svagere end de ioniske eller kovalente bindinger, der findes i andre typer krystaller.
* let at bryde: Fordi IMF'erne er svage, tager det mindre energi at overvinde dem og adskille molekylerne. Dette er grunden til, at molekylære krystaller har lavere smeltepunkter sammenlignet med ioniske eller metalliske krystaller.
* Løs pakning: Molekyler i molekylære krystaller har en tendens til at pakke løst, hvilket yderligere bidrager til deres lavere smeltepunkter. De svagere kræfter og løsere pakning gør det muligt for molekylerne lettere at adskille sig med relativt lidt input af energi.
Her er en analogi: Forestil dig en bunke sand versus en klippe.
* sand: Sandkornene (som molekyler i en molekylær krystal) holdes sammen af svage kræfter. Du kan nemt bryde sandbunken med minimal indsats.
* rock: Klippen (som en ionisk eller metallisk krystal) holdes sammen af stærke kræfter, hvilket kræver meget mere indsats for at bryde.
Eksempler:
* sukker (saccharose): En molekylær krystal holdt sammen af brintbindinger. Det smelter ved en relativt lav temperatur (185 ° C).
* is: En molekylær krystal holdt sammen af brintbindinger. Det smelter ved 0 ° C.
* naphthalen (mothballs): En molekylær krystal holdt sammen af van der Waals styrker. Det smelter ved 80 ° C.
I modsætning:
* natriumchlorid (bordsalt): En ionisk krystal holdt sammen af stærke elektrostatiske kræfter. Det smelter ved 801 ° C.
* jern: En metallisk krystal holdt sammen af metalliske bindinger. Det smelter ved 1538 ° C.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse punkter!
 Varme artikler
Varme artikler
-
 Team skaber ny ultraletvægt, knusningsbestandige tensegrity-metamaterialerNye tensegrity-metamaterialer fra UCI og Georgia Institute of Technology-forskere anvender isolerede kompressionsløkkeelementer, der udelukkende er forbundet gennem et kontinuerligt netværk af trækele
Team skaber ny ultraletvægt, knusningsbestandige tensegrity-metamaterialerNye tensegrity-metamaterialer fra UCI og Georgia Institute of Technology-forskere anvender isolerede kompressionsløkkeelementer, der udelukkende er forbundet gennem et kontinuerligt netværk af trækele -
 Ny belægningsproces giver effektiv beskyttelse af bremseskiverBelægning af en bremseskive med EHLA-processen. Kredit:Fraunhofer ILT, Aachen, Tyskland / Volker Lannert Mere end mange andre bildele, bremseskiver udsættes for gentagne mekaniske belastninger. So
Ny belægningsproces giver effektiv beskyttelse af bremseskiverBelægning af en bremseskive med EHLA-processen. Kredit:Fraunhofer ILT, Aachen, Tyskland / Volker Lannert Mere end mange andre bildele, bremseskiver udsættes for gentagne mekaniske belastninger. So -
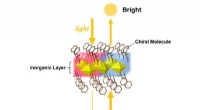 Nyt magnetdesign med spejllignende egenskaberDen magiske spejllignende magnet. Lysstyrken af det transmitterede lys fra magneten ændrer sig alt efter om materialet ses forfra eller bagfra. Kredit:Kouji Taniguchi Forskere ved Tohoku Univers
Nyt magnetdesign med spejllignende egenskaberDen magiske spejllignende magnet. Lysstyrken af det transmitterede lys fra magneten ændrer sig alt efter om materialet ses forfra eller bagfra. Kredit:Kouji Taniguchi Forskere ved Tohoku Univers -
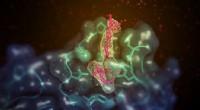 Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterolEt lille molekyle (vist her i pink) med evnen til at øge godt (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). S
Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterolEt lille molekyle (vist her i pink) med evnen til at øge godt (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). S
- Fremtiden ser lys ud for uendeligt genanvendeligt plastik
- Gig-økonomiske chauffører og ryttere med øget risiko for trafikkollisioner
- Dalian Coherent Light Source afslører nye dissociationskanaler i ethanfotokemi
- Hvad er en fortyndet opløsning?
- GRETA, en 3-D gammastråledetektor, får grønt lys for at komme videre
- Hvad er videnskabelige teorier, der viste sig at være forkerte?


