Hvor stærke er partiklerne holdt sammen i væske?
* faste stoffer: Partikler i faste stoffer holdes sammen af stærke kræfter, som ioniske bindinger eller kovalente bindinger. Disse kræfter holder partiklerne i en fast, stiv struktur, hvilket fører til en defineret form og volumen.
* væsker: Partikler i væsker har svagere kræfter end faste stoffer, så de kan bevæge sig mere frit rundt. De er stadig tiltrukket af hinanden, men ikke stærkt nok til at opretholde en fast form. Væsker har formen på deres beholder, men opretholder et konstant volumen.
* Gasser: Partikler i gasser har meget svage kræfter mellem dem. De er frie til at bevæge sig uafhængigt og tilfældigt, hvilket resulterer i ingen fast form eller volumen.
Eksempler på kræfter i væsker:
* Hydrogenbinding: Dette er en stærk type intermolekylær kraft, der forekommer i vand, hvilket forklarer dens relativt høje kogepunkt.
* dipol-dipolinteraktioner: Disse forekommer mellem polære molekyler.
* London Dispersion Forces: Dette er svage kræfter, der forekommer mellem alle molekyler, uanset polaritet.
Derfor er styrken af kræfterne, der holder partikler sammen i en væske, stærkere end i gasser, men svagere end i faste stoffer. Denne balance giver mulighed for de unikke egenskaber ved væsker, såsom fluiditet og evne til at flyde.
Sidste artikelHar syrer en pH større end 7?
Næste artikelHvilke typer materialer opløses i plasma?
 Varme artikler
Varme artikler
-
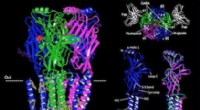 Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t
Struktur af større hjernereceptor, der er behandlingsmål for epilepsi, angst løstArkitekturen af GABAA-receptoren. Kredit:UT Southwestern UT Southwestern-forskere har i dag offentliggjort den første atomare struktur af en hjernereceptor bundet til et lægemiddel, der bruges t -
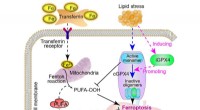 Målretning mod en ny inducerbar isoform til behandling af metabolisk-associeret fedtleversygdomGrafisk abstrakt. Kredit:Acta Pharmaceutica Sinica B (2022). DOI:10.1016/j.apsb.2022.02.003 Metabolisk associeret fedtleversygdom (MAFLD), som tidligere var kendt som ikke-alkoholisk fedtleversygdo
Målretning mod en ny inducerbar isoform til behandling af metabolisk-associeret fedtleversygdomGrafisk abstrakt. Kredit:Acta Pharmaceutica Sinica B (2022). DOI:10.1016/j.apsb.2022.02.003 Metabolisk associeret fedtleversygdom (MAFLD), som tidligere var kendt som ikke-alkoholisk fedtleversygdo -
 Syntetiske brændstoffer kan mindske CO2-fodaftrykketKredit:CC0 Public Domain Syntetiske brændstoffer, lavet ved hjælp af kulstof fanget fra luften, landbrugsaffald eller biomasse, kunne hjælpe transportsektoren med at reducere sin afhængighed af fo
Syntetiske brændstoffer kan mindske CO2-fodaftrykketKredit:CC0 Public Domain Syntetiske brændstoffer, lavet ved hjælp af kulstof fanget fra luften, landbrugsaffald eller biomasse, kunne hjælpe transportsektoren med at reducere sin afhængighed af fo -
 Metaloxid-infunderede membraner kunne tilbyde et lavenergialternativ til kemisk adskillelseEt elementært kort indsamlet med elektronmikroskopi af et brudt tværsnit af hybrid hulfibermembran med en radius på omkring 500 μm. Grønne prikker angiver placeringen af metaloxidet i membranen. Det
Metaloxid-infunderede membraner kunne tilbyde et lavenergialternativ til kemisk adskillelseEt elementært kort indsamlet med elektronmikroskopi af et brudt tværsnit af hybrid hulfibermembran med en radius på omkring 500 μm. Grønne prikker angiver placeringen af metaloxidet i membranen. Det
- Hvad er et par modstridende kræfter, der virker på vand, når det går gennem vandet?
- Hvor lang tid tog det at flyve fra Jorden Månen da?
- Svampetype, der producerer sporer i et sporangium?
- Nye enkeltkrystaller viser lovende elektrisk feltkontrol af magnetisme
- Vigtige fouragerings-hotspots for skovskildpadder er identificeret
- Hvilken proces i stjerner forårsager af store mængder energi?


