Hvorfor har ionisk forbindelse høj elctrisk ledningsevne i den smeltede tilstand og vandopløsning?
* solid tilstand: I fast tilstand er ioniske forbindelser arrangeret i en stiv gitterstruktur. Ionerne holdes i faste positioner af stærke elektrostatiske kræfter. Dette forhindrer den frie bevægelse af ioner, hvilket gør dem til dårlige ledere af elektricitet.
* smeltet tilstand: Når en ionisk forbindelse opvarmes til dens smeltepunkt, svækkes de elektrostatiske kræfter, der holder ionerne sammen. Ionerne slipper fri fra deres faste positioner og bliver mobile. Dette giver dem mulighed for at bære en elektrisk strøm, når der anvendes en potentiel forskel.
* Vandopløsning: Når en ionisk forbindelse opløses i vand, omgiver vandmolekylerne ionerne og "trækker" dem effektivt fra hinanden. Denne proces, kaldet hydrering, svækker de elektrostatiske kræfter mellem ionerne. De hydratiserede ioner kan frit bevæge sig i opløsningen, hvilket muliggør elektrisk ledningsevne.
Kortfattet:
* Mobilitet af ioner er afgørende for elektrisk ledningsevne.
* smeltet tilstand og vandløsning giver den nødvendige bevægelsesfrihed for ionerne.
Fortæl mig, hvis du har andre spørgsmål.
Sidste artikelHvilke frigiver ioner, når de blev opløst i vand?
Næste artikelEr eddike god leder af elektricitet?
 Varme artikler
Varme artikler
-
 Lys på effektivitetstab i organiske solcellerVed hjælp af en kompleks laseropsætning, holdet opdagede, at i modsætning til de seneste rapporter, betydelige ioniseringsenergiforskydninger var nødvendige for at generere ladninger. Kredit:© 2020 KA
Lys på effektivitetstab i organiske solcellerVed hjælp af en kompleks laseropsætning, holdet opdagede, at i modsætning til de seneste rapporter, betydelige ioniseringsenergiforskydninger var nødvendige for at generere ladninger. Kredit:© 2020 KA -
 Nye forskningsresultater kan føre til sikrere og mere kraftfulde lithium-ion-batterierKredit:CC0 Public Domain Virginia Commonwealth University-forskere arbejder på at forbedre ledningsevne og sikkerhed i lithium-ion-batterier, som bruges til at drive mange elektroniske enheder run
Nye forskningsresultater kan føre til sikrere og mere kraftfulde lithium-ion-batterierKredit:CC0 Public Domain Virginia Commonwealth University-forskere arbejder på at forbedre ledningsevne og sikkerhed i lithium-ion-batterier, som bruges til at drive mange elektroniske enheder run -
 Kombinerer sollys og spildevandsnitrat for at gøre verdens nummer 2 kemikalieUIC-forskere skaber et bæredygtigt elektrokemisk system, hvor en solcelle er knyttet til en brønd, der indeholder en flydende opløsning. Når opladet, nitrater fra spildevand i den flydende opløsning o
Kombinerer sollys og spildevandsnitrat for at gøre verdens nummer 2 kemikalieUIC-forskere skaber et bæredygtigt elektrokemisk system, hvor en solcelle er knyttet til en brønd, der indeholder en flydende opløsning. Når opladet, nitrater fra spildevand i den flydende opløsning o -
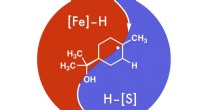 Har du travlt med at udvikle medicin? Her er din chatRice University-forskere udvikler cHAT for at forenkle reduktionen af alkener til mere nyttige mellemmolekyler for lægemidler og andre nyttige kemiske forbindelser. Kredit:West Laboratory/Rice Unive
Har du travlt med at udvikle medicin? Her er din chatRice University-forskere udvikler cHAT for at forenkle reduktionen af alkener til mere nyttige mellemmolekyler for lægemidler og andre nyttige kemiske forbindelser. Kredit:West Laboratory/Rice Unive
- Fysikere sporer atmosfæriske partikler, der producerer mandagens røde himmel
- WhatsApps administrerende direktør Jan Koum forlader Facebook midt i privatlivets fred
- Hvad er to typer genetisk drift?
- Hvad er forskellen mellem cellulær respiration og at få energi fra en log ved at brænde den?
- Nye beviser viser, at gigantiske meteoritnedslag dannede dele af Måneskorpen
- Solstorm vækker betagende nordlys


