Hvilke frigiver ioner, når de blev opløst i vand?
Her er en sammenbrud:
* elektrolytter er forbindelser, der udfører elektricitet, når de opløses i vand. Denne ledningsevne opstår fra tilstedeværelsen af frie ioner, der er ladede partikler, der kan bevæge sig frit.
* ioner er atomer eller molekyler, der har opnået eller mistet elektroner, hvilket giver dem en netto elektrisk ladning.
* vand er et polært opløsningsmiddel, hvilket betyder, at det har en positiv og negativ ende. Denne polaritet giver den mulighed for at interagere med og adskille ionerne i en elektrolyt.
Eksempler på elektrolytter inkluderer:
* salte: For eksempel opløses tabelsalt (NaCl) i vand til dannelse af natriumioner (Na+) og chloridioner (Cl-).
* syrer: Syrer frigiver brintioner (H+), når de opløstes i vand. For eksempel opløses saltsyre (HCI) til dannelse af H+ og cl-ioner.
* baser: Baser frigiver hydroxidioner (OH-), når de opløses i vand. For eksempel opløses natriumhydroxid (NaOH) til dannelse af Na+ og OH-ioner.
Bemærk: Ikke alle stoffer opløses i vand, og dem, der gør, frigiver muligvis ikke nødvendigvis ioner. For eksempel opløses sukker (saccharose) i vand, men adskiller sig ikke i ioner. Det betragtes som en ikke-elektrolyt.
 Varme artikler
Varme artikler
-
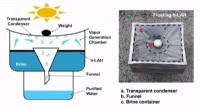 Hydrogelbaseret vandrensningssystem 12 gange bedre end nuværende systemerEt team af forskere fra University of Texas i Austin, samarbejde med en gruppe fra Lockheed Martin Corporation, har udviklet et nyt hydrogelbaseret vandrensningssystem-det er cirka 12 gange bedre end
Hydrogelbaseret vandrensningssystem 12 gange bedre end nuværende systemerEt team af forskere fra University of Texas i Austin, samarbejde med en gruppe fra Lockheed Martin Corporation, har udviklet et nyt hydrogelbaseret vandrensningssystem-det er cirka 12 gange bedre end -
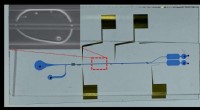 Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top
Mikrofluidisk system med celleadskillende kræfter kan afsløre, hvordan nye patogener angriberEt billede af den in-dråbe celleadskillelse mikrofluidisk chip, viser de mikrofluidiske kanaler og elektroder. Forstørret billede viser en værtscelle og patogene bakterieceller, der adskilles til top -
 Rapid DNA identificerer ofre for undfangelsesbådbrandKredit:U.S. Department of Homeland Security 34 mennesker døde i en tragisk bådbrand den 2. september. 2019, ud for Santa Cruz Islands kyst, Californien. Fem besætningsmedlemmer slap med skader eft
Rapid DNA identificerer ofre for undfangelsesbådbrandKredit:U.S. Department of Homeland Security 34 mennesker døde i en tragisk bådbrand den 2. september. 2019, ud for Santa Cruz Islands kyst, Californien. Fem besætningsmedlemmer slap med skader eft -
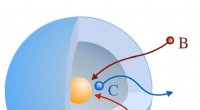 Ny model for bimolekylære reaktioner i nanoreaktorerSkitse af en æggeblomme-skal-type nanoreaktor:reaktanderne A og B diffunderer gennem skallen og reagerer på C ved den katalytisk aktive nanopartikel (gul). Kredit:HZB Teoretiske fysikere har udtæn
Ny model for bimolekylære reaktioner i nanoreaktorerSkitse af en æggeblomme-skal-type nanoreaktor:reaktanderne A og B diffunderer gennem skallen og reagerer på C ved den katalytisk aktive nanopartikel (gul). Kredit:HZB Teoretiske fysikere har udtæn
- Jupiter kunne være en ideel detektor for mørkt stof
- Hvem var videnskabsmand, der gav os bevægelseslov?
- Er en hovedstjerne i spektral type A -diameter større end Jupiter?
- Forskere modellerer kilden til udbrud på Jupiters måne Europa
- Undersøgelse bruger satellitdata til at lokalisere udbredt olieindustri
- Hvorfor betaler forbrugerne mere? Forskning finder den overraskende effekt af forbrugernes lokale id…


