Hvorfor opløses nogle stoffer ikke i vand i noget mærkbart omfang?
1. Polaritet og "som opløses som"
* vand er et polært molekyle: Dette betyder, at det har en positiv og en negativ ende på grund af ujævn deling af elektroner.
* polære stoffer opløses i polære opløsningsmidler: Vand tiltrækker andre polære molekyler (som sukker eller salte) på grund af de elektrostatiske interaktioner mellem deres modsatte ladninger.
* ikke -polære stoffer opløses ikke i vand: Ikke -polære molekyler, som olier eller fedt, mangler disse ladninger. De er mere tiltrukket af hinanden end vand, så de forbliver adskilte.
2. Intermolekylære kræfter
* stærkere kræfter i opløstelsen: Nogle stoffer har stærkere intermolekylære kræfter (som hydrogenbinding) i sig selv, end de gør med vand. Dette gør det energisk ugunstigt for dem at bryde fra hinanden og interagere med vand. Eksempler inkluderer langkædede kulbrinter eller nogle polymerer.
3. Gitter Energy
* ioniske forbindelser: Nogle ioniske forbindelser (som calciumcarbonat) har stærke ioniske bindinger, der holder deres gitterstruktur sammen. Den energi, der kræves for at bryde disse bindinger, er større end den energi, der er opnået ved solvation ved vand.
4. Entropy
* Nedsat entropi: Når nogle stoffer opløses, reducerer de faktisk entropien af opløsningen. Dette kan være ugunstigt, og stoffet opløses muligvis ikke godt.
5. Størrelse og form
* store eller komplekse molekyler: Meget store eller komplekse molekyler kan have problemer med at passe mellem vandmolekyler, hvilket gør solvation mindre sandsynlig.
6. Tilstedeværelse af funktionelle grupper
* hydrofobe grupper: Molekyler med store hydrofobe (vandafvisende) grupper, såsom lange kæder af kulbrinter, vil modstå opløsning i vand.
Eksempler:
* olie og vand: Olie er ikke -polært, mens vand er polært. De blandes ikke.
* sand: Sand er primært siliciumdioxid (SiO2), en meget stabil ionisk forbindelse med stærke bindinger.
* plast: Mange plast er lange kæder af ikke -polære kulbrinter, hvilket gør dem uopløselige i vand.
I resuméet afhænger opløseligheden af et stof i vand af kræfteres balance mellem opløsningsmiddel og opløsningsmiddel. Hvis kræfterne, der favoriserer adskillelse, er stærkere end dem, der favoriserer blanding, vil stoffet ikke opløses.
Sidste artikelHvorfor squash en solid eller væske?
Næste artikelReaktionen 2 mg o2 mgo er et eksempel på?
 Varme artikler
Varme artikler
-
 Ny undersøgelse kaster lys over molekylær bevægelseMolekylært bevægeligt billede. Kredit:University of Nottingham Ny forskning har vist, hvordan syntetiske selvfremstillede fibre kan lede molekylær bevægelse, der kan drives af lys over lange afsta
Ny undersøgelse kaster lys over molekylær bevægelseMolekylært bevægeligt billede. Kredit:University of Nottingham Ny forskning har vist, hvordan syntetiske selvfremstillede fibre kan lede molekylær bevægelse, der kan drives af lys over lange afsta -
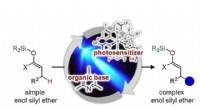 Muliggør selektiv carbon-carbon-bindingsdannelse i enolsilylethers iboende inaktive positionFigur:En ny transformation til effektiv syntese af komplekse organiske molekyler Nagoya University forskere har opdaget en ny måde at ændre reaktanter, der er blevet bredt undersøgt og anvendt i o
Muliggør selektiv carbon-carbon-bindingsdannelse i enolsilylethers iboende inaktive positionFigur:En ny transformation til effektiv syntese af komplekse organiske molekyler Nagoya University forskere har opdaget en ny måde at ændre reaktanter, der er blevet bredt undersøgt og anvendt i o -
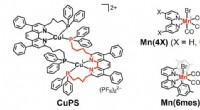 Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo
Store fremskridt for kulstoffangst ved hjælp af jordrige elementer som fotokatalytisk systemStrukturen af CuPS, kobberkomplekset, der opfører sig som en redox -lysfølsomhed, og den manganbaserede katalysator udviklet i undersøgelsen. Kredit: Journal of the American Chemical Society Fo -
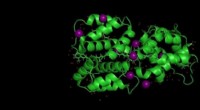 Vores første kig på et nyt lysabsorberende protein i cyanobakterierKredit:Michigan State University Cyanobakterier er små, hårdføre organismer. Hver celle er 25 gange mindre end et menneskehår, men lad ikke størrelsen narre dig. Deres kollektive evne til at udvid
Vores første kig på et nyt lysabsorberende protein i cyanobakterierKredit:Michigan State University Cyanobakterier er små, hårdføre organismer. Hver celle er 25 gange mindre end et menneskehår, men lad ikke størrelsen narre dig. Deres kollektive evne til at udvid
- Forskere låser op for kræftfremkaldende mekanisme af E. coli-toksin med syntetisk biologi tilgang
- Hvad er mafiske klipper?
- Resultater på A-niveau viser de mønstre af ulemper, regeringen skal tackle
- Det tempo, hvormed verdens permafrostjorde opvarmes
- Forskning viser, at digital filmpirateri efter udgivelsen kan øge billetsalget
- Forskel mellem kontinentale og oceaniske plader


