Hvorfor sker diffusion i gasser og væsker, men ikke faste stoffer?
Gasser:
* høj kinetisk energi: Gaspartikler bevæger sig hurtigt og tilfældigt og kolliderer konstant med hinanden og væggene i deres beholder.
* store afstande mellem partikler: Der er meget plads mellem gasmolekyler, der giver mulighed for let bevægelse og blanding.
* Ingen faste positioner: Gaspartikler kan frit bevæge sig overalt i deres beholder.
væsker:
* Moderat kinetisk energi: Flydende partikler bevæger sig mindre hurtigt end gaspartikler, men har stadig nok energi til at bevæge sig rundt.
* mindre plads mellem partikler: Flydende partikler er tættere sammen end gaspartikler, men har stadig en vis frihed til at bevæge sig.
* Ingen faste positioner (men begrænset bevægelse): Flydende partikler kan bevæge sig rundt, men deres bevægelse er begrænset af tilstedeværelsen af nabopartikler.
faste stoffer:
* lav kinetisk energi: Faste partikler vibrerer i faste positioner. De har ikke nok energi til at bevæge sig frit.
* meget lidt plads mellem partikler: Faste partikler er tæt pakket sammen og efterlader meget lidt plads til bevægelse.
* faste positioner: Faste partikler holdes i et stift, ordnet arrangement.
Diffusion kræver, at partikler bevæger sig fra et område med høj koncentration til et område med lav koncentration. Fordi gas- og flydende partikler har friheden til at bevæge sig, kan de diffundere. Imidlertid forhindrer den tæt pakket og faste karakter af faste stoffer denne form for bevægelse, hvilket gør diffusion umulig.
Tænk på det sådan:
* gas: Forestil dig et værelse fuld af mennesker med masser af plads til at bevæge sig rundt. De kan let sprede sig og blande.
* væske: Forestil dig folk pakket sammen i en overfyldt elevator. De kan stadig bevæge sig rundt, men deres bevægelse er begrænset.
* fast: Forestil dig folk, der står i en stram linje. De kan kun vibrere på plads og kan ikke bevæge sig frit.
Mens faste stoffer ikke diffunderer, kan de udvise en meget langsom proces kaldet *interdiffusion *, hvor atomer ved grænsefladen mellem to forskellige faste stoffer langsomt kan udveksle positioner. Dette er en meget langsom proces og er normalt kun signifikant ved høje temperaturer.
 Varme artikler
Varme artikler
-
 Ny metode til varmeledning kunne være en game changer for serverfarme og flyLaboratoriemedlem Mojtaba Edalatpour viser den termiske diode udviklet af Boreykos team. Kredit:Virginia Tech Jonathan Boreyko, en lektor i maskinteknik, har udviklet en termisk styringsteknologi
Ny metode til varmeledning kunne være en game changer for serverfarme og flyLaboratoriemedlem Mojtaba Edalatpour viser den termiske diode udviklet af Boreykos team. Kredit:Virginia Tech Jonathan Boreyko, en lektor i maskinteknik, har udviklet en termisk styringsteknologi -
 Udstødningsgassen fra et kraftværk kan genvindes og bruges som et reaktionsråmaterialeFig. 1 Oversigt over processen ved hjælp af H2 -stripping -regenereringsteknologi CO2 -partialtryk i desorberen sænkes af H2 tilført til bunden af desorberen og masseoverførslen af CO2 fra en flyd
Udstødningsgassen fra et kraftværk kan genvindes og bruges som et reaktionsråmaterialeFig. 1 Oversigt over processen ved hjælp af H2 -stripping -regenereringsteknologi CO2 -partialtryk i desorberen sænkes af H2 tilført til bunden af desorberen og masseoverførslen af CO2 fra en flyd -
 Forskere bygger en holdbar molekylær krypteringsnøgle af sekvensdefinerede polymererEn molekylær krypteringsnøgle blev indlejret i blæk (venstre billede) af et brev (højre billede), som blev sendt og analyseret for at dekryptere en fil. Kredit:Tilpasset fra ACS Central Science . M
Forskere bygger en holdbar molekylær krypteringsnøgle af sekvensdefinerede polymererEn molekylær krypteringsnøgle blev indlejret i blæk (venstre billede) af et brev (højre billede), som blev sendt og analyseret for at dekryptere en fil. Kredit:Tilpasset fra ACS Central Science . M -
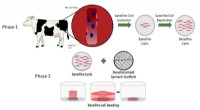 Decellulariseret spinat tjener som en spiselig platform for laboratoriedyrket kødDette diagram viser de trin, Boston College og WPI-forskere tog for at isolere og udså primære bovine satellitceller på et decellulariseret spinatbladstillads. Kredit:Food Bioscience Spinat, et om
Decellulariseret spinat tjener som en spiselig platform for laboratoriedyrket kødDette diagram viser de trin, Boston College og WPI-forskere tog for at isolere og udså primære bovine satellitceller på et decellulariseret spinatbladstillads. Kredit:Food Bioscience Spinat, et om
- Hvad studerer forskere for at lære om stjerner?
- En ToM-baseret algoritme til estimering af menneskelige hensigter til robotiserede lagre
- Perseverances robotarm begynder at udføre videnskab
- Skilsmissefrekvensen falder:Er canadiere for fattige til at bryde op?
- Forstå hvordan fladt fosfor vokser
- Hvorfor er større dyr mere energieffektive? Et nyt svar på et århundreder gammelt biologisk pusle…


