Hvordan er Amonia Gas forberedt?
1. Laboratorieforberedelse:
* reaktion af ammoniumsalte med stærke baser: Dette er den mest almindelige laboratoriemetode. Ammoniumchlorid (NH₄CL) eller ammoniumsulfat ((NH₄) ₂SO₄) reageres med en stærk base som natriumhydroxid (NaOH) eller calciumhydroxid (Ca (OH) ₂) for at producere ammoniakgas.
* Ligning: 2NH₄CL + CA (OH) ₂ → CACL₂ + 2H₂O + 2NH₃
* Opvarmning af ammoniumsalte: Ammoniumsalte som ammoniumnitrat (NH₄no₃) nedbrydes ved opvarmning for at producere ammoniakgas.
* Ligning: Nh₄no₃ → n₂o + 2h₂o
2. Industriel produktion:
* haber-bosch-proces: Dette er den primære industrielle metode til produktion af ammoniak. Det involverer at reagere nitrogengas (N₂) med brintgas (H₂) under højt tryk (omkring 200 atm) og temperatur (ca. 500 ° C) i nærvær af en jernkatalysator.
* Ligning: N₂ + 3H₂ ⇌ 2NH₃
Generel procedure for laboratorieforberedelse:
1. opsætning: En rundbundet kolbe er forbundet til et leveringsrør, der fører til et gasopsamlingsapparat (som en omvendt gradueret cylinder fyldt med vand).
2. reaktionsblanding: Tilsæt ammoniumsalt og den stærke base til kolben.
3. Opvarmning: Varm kolben forsigtigt for at starte reaktionen.
4. Gasindsamling: Den producerede ammoniakgas vil fortrænge vand i den graduerede cylinder.
5. tørring: Ammoniakgassen kan tørres ved at føre den gennem et tørrør indeholdende calciumchlorid (CACL₂).
Sikkerhedsforholdsregler:
* Ammoniakgas er en stærk irriterende og kan forårsage luftvejsproblemer. Brug en røghætte under forberedelsen.
* Undgå kontakt med ammoniakgas og dens løsninger.
* Bær passende sikkerhedsudstyr som handsker, beskyttelsesbriller og laboratoriefrakker.
Bemærk: De nøjagtige procedurer og sikkerhedsforholdsregler kan variere afhængigt af den anvendte specifikke metode og opsætning. Det er vigtigt at konsultere passende laboratoriemanualer og sikkerhedsretningslinjer, inden de forsøger at forberede ammoniakgas.
Sidste artikelHvad bruger forskere til at måle, når en væske bliver solid?
Næste artikelHvad er en af datterelementerne Urainium-238?
 Varme artikler
Varme artikler
-
 Skaber ringe i naturlig antibiotikasynteseTværfaglige undersøgelser afslører, hvordan naturen skaber et globalt brugt antibiotikum. Kredit:University of Bristol Forskere ved University of Bristol har afsløret hemmelighederne bag nøglering
Skaber ringe i naturlig antibiotikasynteseTværfaglige undersøgelser afslører, hvordan naturen skaber et globalt brugt antibiotikum. Kredit:University of Bristol Forskere ved University of Bristol har afsløret hemmelighederne bag nøglering -
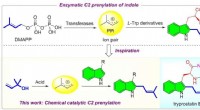 Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den
Bioinspireret syrekatalyseret C2-prenylering af indolderivaterBiomimetisk katalyse er et nyt begreb, der efterligner nøglefunktioner i enzymatisk proces. Prenylering er en allestedsnærværende proces, der findes i næsten alle levende organismer. Inspireret af den -
 Leviathan polymer børste lavet med E. coli holder bakterier i skakMikroskopisk monster:Et tilfældigt øjeblik i laboratoriet førte til skabelsen af polymerbørster 100 gange den sædvanlige størrelse. Børsterne er synlige under mikroskopet, hvorimod polymerbørster no
Leviathan polymer børste lavet med E. coli holder bakterier i skakMikroskopisk monster:Et tilfældigt øjeblik i laboratoriet førte til skabelsen af polymerbørster 100 gange den sædvanlige størrelse. Børsterne er synlige under mikroskopet, hvorimod polymerbørster no -
 Miljøvenlig produktion af mandelsyremyresyre, hovedbestanddelen af myregift, spiller en nøglerolle i den enzymatiske syntese af mandeinsyre. En tre-enzym-kaskade omdanner de billige og sikre udgangsmaterialer oxalsyre og benzaldehyd u
Miljøvenlig produktion af mandelsyremyresyre, hovedbestanddelen af myregift, spiller en nøglerolle i den enzymatiske syntese af mandeinsyre. En tre-enzym-kaskade omdanner de billige og sikre udgangsmaterialer oxalsyre og benzaldehyd u
- Slanger der er brune med stripes
- Et objekt, der hovedsageligt er sammensat af is, kredserer solen i en elliptisk sti dette sandsynlig…
- Hvad er forholdet på besat af 1 mol O2 og O3?
- Rene carbon nanorør med suveræne egenskaber
- Hvad er de intermolekylære tiltrækningskræfter mellem HCl-molekyler?
- SU(N)-stof er omkring 3 milliarder gange koldere end det dybe rum


