Hvor mange elektroner af en calcium er involveret i kemisk binding?
* Elektronisk konfiguration: Calcium har en elektronisk konfiguration af 2, 8, 8, 2.. Dette betyder, at det har to elektroner i sin yderste skal (valensskallen).
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af otte elektroner i deres valensskal (Octet -reglen).
* taber elektroner: Calcium er i gruppe 2 i den periodiske tabel, hvilket betyder, at det har en tendens til at miste sine to valenselektroner til at blive en positivt ladet ion (Ca²⁺). Dette efterlader det med en fuld ydre skal (som den ædle gas -argon).
Derfor er calciums to valenselektroner ansvarlige for dens kemiske bindingsadfærd.
 Varme artikler
Varme artikler
-
 Dekontaminering af mandler og nødder med komprimeret kuldioxidBakteriekulturen udplades i et næringsmedium. Kredit:Karen Fuchs/Fraunhofer UMSICHT Der går næsten ikke en dag, uden at producenter husker mad, der er plettet af urenheder. Selv tørre fødevarer, g
Dekontaminering af mandler og nødder med komprimeret kuldioxidBakteriekulturen udplades i et næringsmedium. Kredit:Karen Fuchs/Fraunhofer UMSICHT Der går næsten ikke en dag, uden at producenter husker mad, der er plettet af urenheder. Selv tørre fødevarer, g -
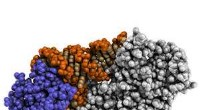 Nøglen til at udvide genetisk kode beskrevetEn illustration af biokemisk sammensætning af pyrrolysyl-tRNA syntetase (PylRS) kompleks, en af nøglerne til at udvide den genetiske kode. Kredit:Yale University Yale -forskere har beskrevet ato
Nøglen til at udvide genetisk kode beskrevetEn illustration af biokemisk sammensætning af pyrrolysyl-tRNA syntetase (PylRS) kompleks, en af nøglerne til at udvide den genetiske kode. Kredit:Yale University Yale -forskere har beskrevet ato -
 Supermaterialer ud af mikrobølgeovnenKredit:CC0 Public Domain Ved hjælp af ikke-konventionelle metoder, Christina Birkel og hendes kolleger i Kemisk Institut ved TU Darmstadt producerer metallisk keramik og nye materialer til fremtid
Supermaterialer ud af mikrobølgeovnenKredit:CC0 Public Domain Ved hjælp af ikke-konventionelle metoder, Christina Birkel og hendes kolleger i Kemisk Institut ved TU Darmstadt producerer metallisk keramik og nye materialer til fremtid -
 Cysteinsyntese var et nøgletrin i livets oprindelse:undersøgelseKredit:Unsplash/CC0 Public Domain I et vigtigt skridt under den tidlige udvikling af livet på Jorden, dannelsen af aminosyren cystein leverede vitale katalysatorer, som gjorde det muligt for de
Cysteinsyntese var et nøgletrin i livets oprindelse:undersøgelseKredit:Unsplash/CC0 Public Domain I et vigtigt skridt under den tidlige udvikling af livet på Jorden, dannelsen af aminosyren cystein leverede vitale katalysatorer, som gjorde det muligt for de


