Hvad sker der med væske, når det absorberer eller frigives varme?
Når en væske absorberer varme:
* Øget kinetisk energi: Molekylerne inden for den flydende forstærkning kinetisk energi. Dette betyder, at de bevæger sig hurtigere og vibrerer mere kraftigt.
* udvidelse: Når molekylerne bevæger sig hurtigere, spredte de sig, hvilket får væsken til at udvide i volumen. Dette er grunden til, at et glas vand oversvømmer lidt, hvis du opvarmer det.
* faseændring (mulig): Hvis der absorberes nok varme, kan væsken skifte til en gas (fordampning eller kogning). Dette skyldes, at molekylerne har fået nok energi til at overvinde kræfterne, der holder dem sammen som en væske.
Når en væske frigiver varme:
* Nedsat kinetisk energi: Molekylerne i væsken mister kinetisk energi. De bremser ned og vibrerer mindre.
* sammentrækning: Når molekylerne bremser, bevæger de sig tættere sammen, hvilket får væsken til at sammentrække i volumen. Dette er grunden til, at vand udvides, når det fryser, men kontrakter, når det afkøles fra stuetemperatur til frysning.
* faseændring (mulig): Hvis der frigøres nok varme, kan væsken skifte til et fast stof (frysning). Dette skyldes, at molekylerne har mistet nok energi til at blive holdt sammen i en mere stiv, krystallinsk struktur.
Vigtige noter:
* Specifik varmekapacitet: Forskellige væsker har forskellige evner til at absorbere eller frigive varme. Denne egenskab kaldes specifik varmekapacitet. Vand har en relativt høj specifik varmekapacitet, hvilket betyder, at det kræver en masse varme at hæve temperaturen.
* Varmeoverførsel: Varme kan overføres mellem væsker og deres omgivelser ved ledning, konvektion og stråling.
Kortfattet:
Væsker reagerer på ændringer i temperaturen ved at ændre den kinetiske energi i deres molekyler. Dette fører til ekspansion, når varme absorberes og sammentrækning, når der frigøres varme. Hvis der absorberes eller frigives nok varme, kan væsken ændre sin tilstand af stof (fordampning, koge, fryse).
 Varme artikler
Varme artikler
-
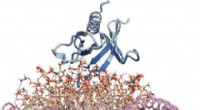 Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove
Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove -
 Fremstillingen af middelalderlig blingEn ny undersøgelse afslører, hvordan middelalderlige håndværkere pyntede tekstiler med guld. Kredit:The American Chemical Society Guld har længe været værdsat for sin luksuriøse glitter og nuance,
Fremstillingen af middelalderlig blingEn ny undersøgelse afslører, hvordan middelalderlige håndværkere pyntede tekstiler med guld. Kredit:The American Chemical Society Guld har længe været værdsat for sin luksuriøse glitter og nuance, -
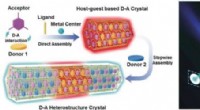 Heterostrukturkrystaller kunne lyse vejen til optiske kredsløbKredit:Wiley-VCH Det kan være muligt at nå nye niveauer af miniaturisering, hastighed, og databehandling med optiske kvantecomputere, som bruger lys til at transportere information. For det, vi ha
Heterostrukturkrystaller kunne lyse vejen til optiske kredsløbKredit:Wiley-VCH Det kan være muligt at nå nye niveauer af miniaturisering, hastighed, og databehandling med optiske kvantecomputere, som bruger lys til at transportere information. For det, vi ha -
 Inspireret af knogler, nyt adaptivt materiale styrkes fra vibrationerPME-forskere har udviklet et nyt gelmateriale (hvidt), der efterligner knogler og bliver stærkere, når det udsættes for vibrationer, hvilket kunne føre til nye klæbemidler og bedre måder at integrere
Inspireret af knogler, nyt adaptivt materiale styrkes fra vibrationerPME-forskere har udviklet et nyt gelmateriale (hvidt), der efterligner knogler og bliver stærkere, når det udsættes for vibrationer, hvilket kunne føre til nye klæbemidler og bedre måder at integrere
- Hvor specifikt protein kan detekteres i western blot?
- Forskere skaber en mere nøjagtig model for, hvordan nogle mikrober søger efter næringsstoffer
- Hvad er horoskoperne datoer?
- UK teenager døde efter negative virkninger af onlineindhold:retsmediciner
- Næste generations triggere til CERN-detektorer
- Hvis flere af os arbejder hjemmefra efter coronavirus, er vi nødt til at gentænke byplanlægningen


