Hvad er en ujævn fordeling af opladet i atom?
Her er en sammenbrud:
* atomer er neutrale: Atomer har et lige stort antal protoner (positiv ladning) og elektroner (negativ ladning), hvilket gør dem til generelt neutrale neutrale.
* elektroner er ikke jævnt fordelt: Selvom atomet er neutral, er elektronerne ikke altid jævnt fordelt omkring kernen. Dette skyldes de forskellige elektronegativiteter af atomer i et molekyle.
* Elektronegativitet: Elektronegativitet er et atoms evne til at tiltrække elektroner i en binding. Flere elektronegative atomer trækker elektronerne tættere på dem og skaber en delvis negativ ladning på dette atom og en delvis positiv ladning på det mindre elektronegative atom.
* dipolmoment: Denne ujævne fordeling af ladning skaber et dipolmoment , et mål for adskillelse af positive og negative ladninger inden for et molekyle.
* polære molekyler: Molekyler med betydelige dipolmomenter kaldes polære molekyler . De har en "positiv ende" og en "negativ ende" på grund af den ujævne ladningsfordeling.
Eksempler:
* vand (H₂O): Oxygen er mere elektronegativ end brint, så elektronerne i O-H-bindingerne bruger mere tid tættere på iltatomet. Dette skaber en delvis negativ ladning på ilt og delvis positive ladninger på hydrogenerne.
* kuldioxid (co₂): Oxygenatomerne er mere elektronegative end carbonatomet. Fordi molekylet er lineært, annullerer dipolmomenterne i de to C-O-bindinger hinanden, hvilket resulterer i en ikke-polær molekyle.
At forstå dipolmomenter er vigtig, fordi det hjælper os med at forudsige opførelsen af molekyler, såsom deres opløselighed i forskellige opløsningsmidler og deres evne til at interagere med andre molekyler.
Sidste artikelHvad er tabet og gevinsten af elektroner til at danne ioner?
Næste artikelOpløses den sammensatte PBI4 i vand?
 Varme artikler
Varme artikler
-
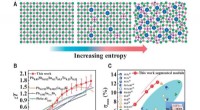 Højentropi-stabiliserede chalcogenider med høj termoelektrisk ydeevneForbedring af ydeevnen af termoelektriske materialer og moduler gennem entropiteknik. (A) Diagram over gitterforvrængning med stigende entropi. Den lyserøde, rød, grøn, blå, og lilla kugler repræsen
Højentropi-stabiliserede chalcogenider med høj termoelektrisk ydeevneForbedring af ydeevnen af termoelektriske materialer og moduler gennem entropiteknik. (A) Diagram over gitterforvrængning med stigende entropi. Den lyserøde, rød, grøn, blå, og lilla kugler repræsen -
 Billig tin pakker et stort slag for fremtiden for superkapacitorerForskere dopede koboltoxid med tin for at skabe en mere effektiv elektrode til brug i superkapacitorer. Dette mikroskopiske billede viser det nye materiale på grafenfilm. Kredit:JIa Zhu/Penn State
Billig tin pakker et stort slag for fremtiden for superkapacitorerForskere dopede koboltoxid med tin for at skabe en mere effektiv elektrode til brug i superkapacitorer. Dette mikroskopiske billede viser det nye materiale på grafenfilm. Kredit:JIa Zhu/Penn State -
 Afdækning af hemmelighederne bag materialenedbrydning i et lithium-ion-batteriSkematisk diagram af KIST batterianalyseplatform. Kredit:Korea Institute of Science and Technology (KIST) Midt i den globale indsats for CO2-neutralitet er bilproducenter over hele verden aktivt en
Afdækning af hemmelighederne bag materialenedbrydning i et lithium-ion-batteriSkematisk diagram af KIST batterianalyseplatform. Kredit:Korea Institute of Science and Technology (KIST) Midt i den globale indsats for CO2-neutralitet er bilproducenter over hele verden aktivt en -
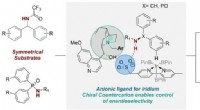 Metalkatalyserede reaktioner gjort enantioselektive ved brug af chiral kationKredit:University of Cambridge Forskere her har fundet frem til en strategi for at gøre en overgangsmetalkatalyseret kemisk reaktion enantioselektiv ved brug af en chiral kation. Arbejdet blev udf
Metalkatalyserede reaktioner gjort enantioselektive ved brug af chiral kationKredit:University of Cambridge Forskere her har fundet frem til en strategi for at gøre en overgangsmetalkatalyseret kemisk reaktion enantioselektiv ved brug af en chiral kation. Arbejdet blev udf
- Venus flyver forbi på vej til Merkur
- Intel siger, at chips adresserer fejl, der skal frigives i år
- Hvem er den berømte ruminnovator?
- Er kaliumhydroxid hygroskopisk spildevand eller deliquescent?
- Hvad sker der med trykket, når volumen ændres?
- Coronavirus-sporingsapp, der sætter privatlivets fred først


